治験Phase3開始目前。へその緒由来の“新しい再生医療等製品”で業界をリードする注目ベンチャー「ヒューマンライフコード」



- へその緒(臍帯)由来の間葉系間質細胞(UC-MSCs)でPhase3の開始が目前のバイオベンチャー
- 臍帯由来MSCsの商用化に向け、医薬品卸・医療総合商社、東証プライム上場大手製薬会社、国立大学などと連携。法規制・技術・供給体制の3つの壁を突破
- まずは希少疾患・小児疾患から承認取得を狙い、糖尿病性合併症やサルコペニアといった巨大慢性疾患市場への適応拡大を計画
- 細胞供給・製法ライセンス事業を通じて海外展開を加速(9月中に大型リリース発表予定)
- 臍帯由来MSCsの免疫調整と組織修復という本質的な機能に基づき、希少疾患・小児疾患での承認取得を起点に、糖尿病性合併症(対象:約1.7億人※1)やサルコペニア(対象:約1億人※2)など巨大慢性疾患市場へ適応拡大を計画。これにより数兆円規模※3のグローバル市場獲得が視野に入る


チームについて
多彩な専門家が事業化を推進。新しい再生医療の未来を切り拓く

アドバイザーは様々な分野で実績ある医師、また企業経営の第一人者等で構成
経営戦略アドバイザー 淺川 一雄
・ノバルティスファーマ元常務取締役
・シンバイオ製薬元代表取締役副社長
経営戦略アドバイザー 矢吹 博隆
・サンバイオ 元シニアアドバイザー
・産業革新機構 元シニアアドバイザー
グローバル戦略アドバイザー Andy C. Ye
Perella Weinberg Partners Director
メディカルアドバイザー 小澤 敬也
・東京大学医科学研究所附属病院長
・自治医科大学名誉教授・客員教授
メディカルアドバイザー 長村 登紀子
・東京大学医科学研究所附属病院 臍帯血・臍帯バンク長
統計解析学アドバイザー 手良向 聡
・京都府立医科大学大学院医学研究科 生物統計学 教授
沿革・株主構成について
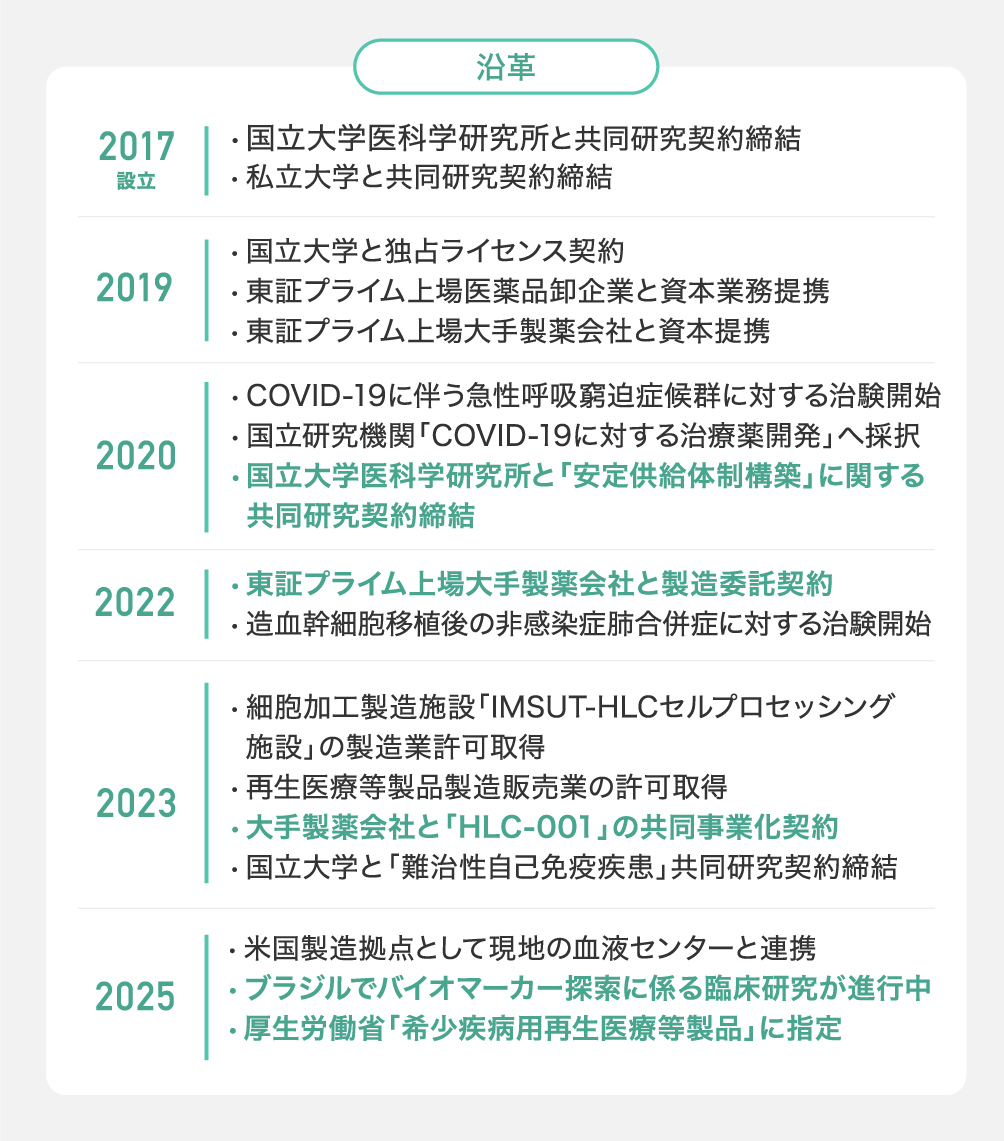
へその緒(臍帯)由来の細胞治療の上市に向け事業が順調に進捗
NEXTユニコーンとして認定。大手企業なども期待し、累計23億円の資金調達を実現

事業について
1本のへその緒から命をつなぐ日本発バイオスタートアップ
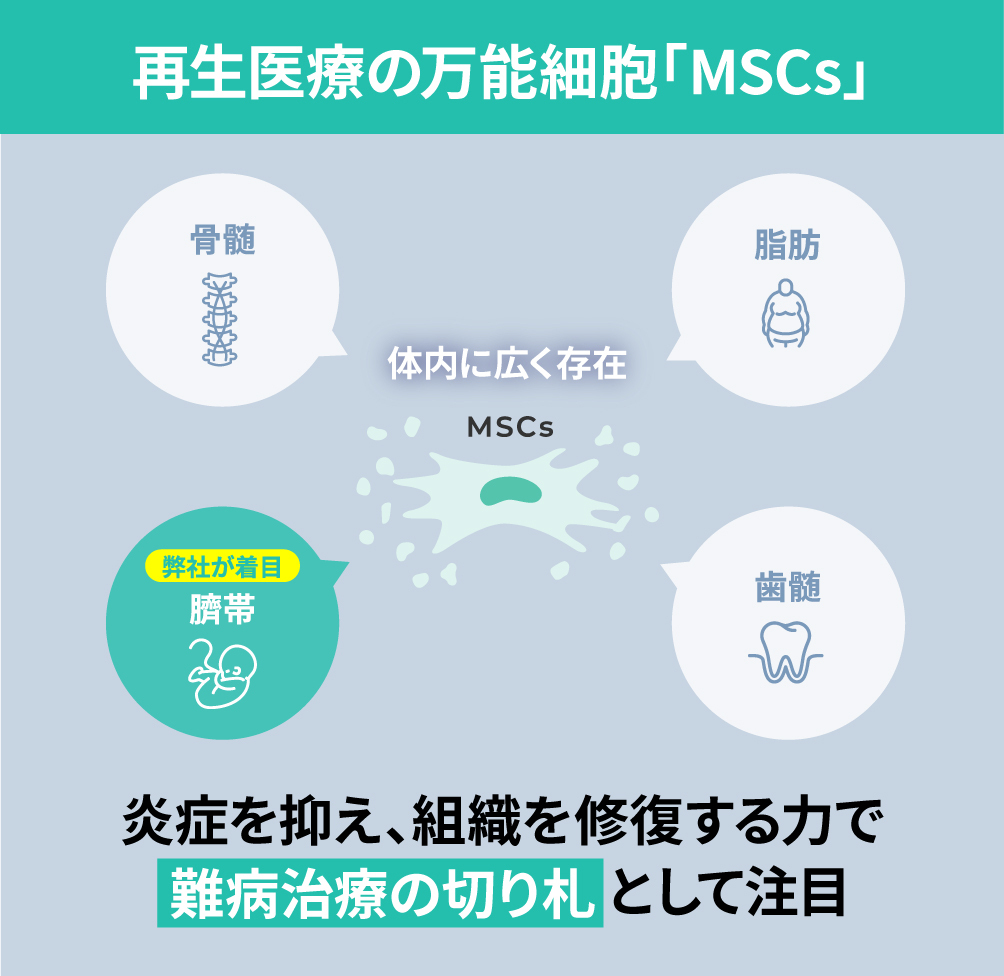
弊社は、新生児の臍帯(へその緒)から採取できる「間葉系間質細胞(MSCs)」を活用した細胞治療(再生医療等製品)の研究開発・製造・商業化に取り組む、日本発バイオスタートアップです。
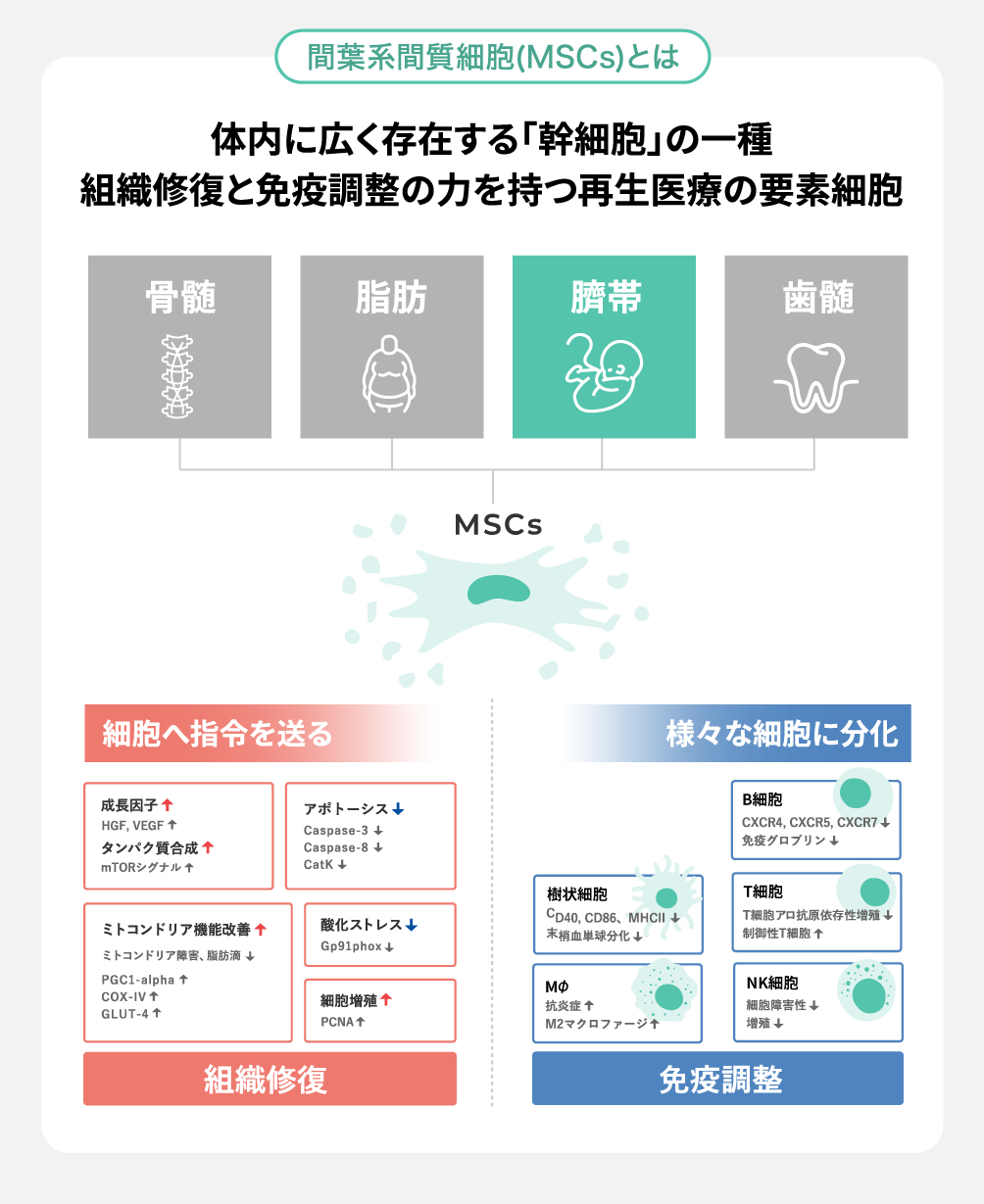
MSCsは体内に広く存在する「幹細胞」の一種で、組織修復と免疫調整の力を持つことから、再生医療の要素細胞として利用されています。
しかし、従来の細胞治療では、18〜45歳の健常者の骨髄や脂肪等から採取したドナー細胞が用いられてきましたが、以下のような課題がありました※。
・細胞増殖能に個体差がある
・採取に痛みを伴う
・ドナーのほとんどを海外に依存している
一方、臍帯から採取できる「間葉系間質細胞(MSCs)」は、細胞修復や免疫調整などの機能を有する上に、従来のドナー細胞と比較した際に以下のような利点があります※。
・高い均質性と細胞増殖能をもつ
・母子に無侵襲で採取に痛みを伴わない
・国内で安定的に調達・備蓄が可能
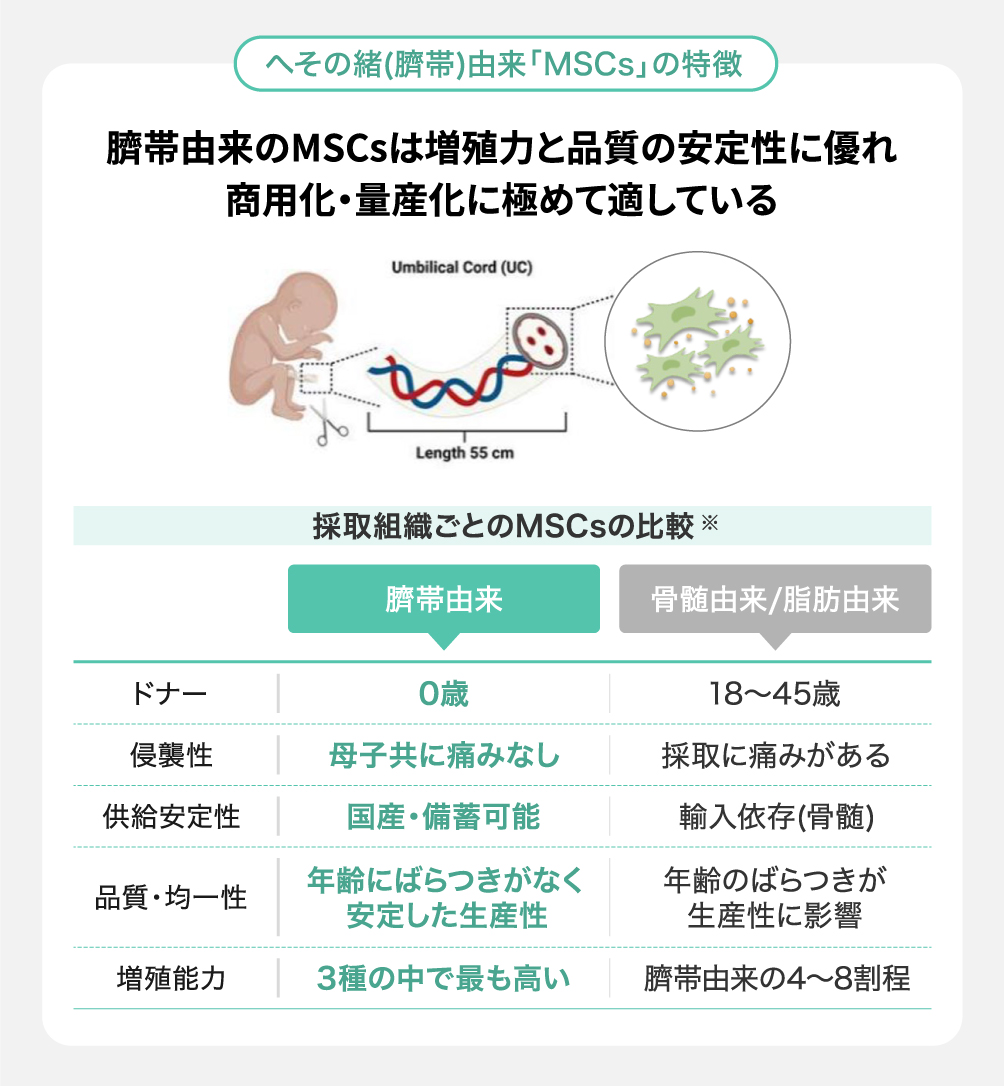
産業化に必要な3つの壁を乗り越えて医療資源化に寄与
弊社は、再生医療領域で事業化を進めるにあたり、制度面・事業面・技術面における高い壁を乗り越えて参入障壁を構築しています。
法的な壁:「胞衣(えな)及び産汚物取締条約」の緩和通知の取得

臍帯の取扱いに関する「胞衣(えな)及び産汚物取締条例」と呼ばれる法的規制に対し、自治体との協議を重ね、東京都から緩和通知を取得しました。これにより、他社が足を踏み入れにくい領域でいち早く実行フェーズへと進む体制を整えました。
技術的な壁:国立大学の製造技術・ノウハウの独占グローバルライセンス契約を締結
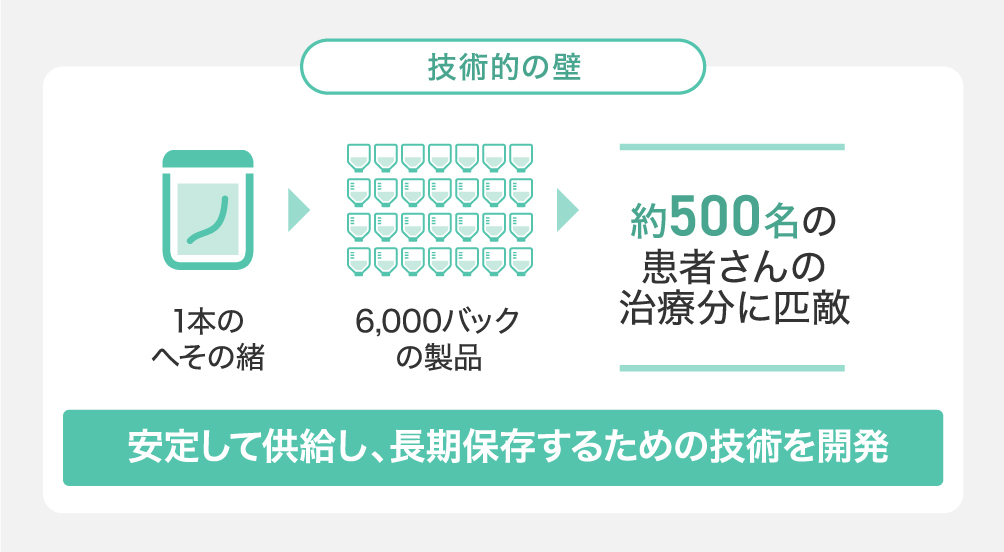
弊社のコア技術は、国立大学医科学研究所との共同研究体制に基づき、コアとなる臍帯由来細胞の技術に関する独占的グローバルライセンスを取得し実現しています。これにより、臨床グレードの品質を有する「MSCs」の安定的な供給と長期保存(備蓄)が可能となっています。
今後の国内外展開や疾患別パイプラインの拡張においても、強固な知財基盤の上に戦略を描ける体制が整っています。
サプライチェーンの壁:大企業とのパートナーシップによる国産国消のインフラを構築

国産かつ保存性に優れた「MSCs」を提供できる点は、サプライチェーンの安全保障や災害対応を含めた医療体制の強化にも資するものです。
また、大手製薬・流通企業との連携により、研究開発から製造・流通・臨床現場への供給まで一貫した体制を構築しています。
弊社は、これらの取り組みを通じて日本発の臍帯由来「MSCs」を用いた独自の細胞治療エコシステムを確立し、本エコシステムを必要とする国内外の国・地域の医療現場に向け、社会実装を推進したいと考えています。
パイプライン
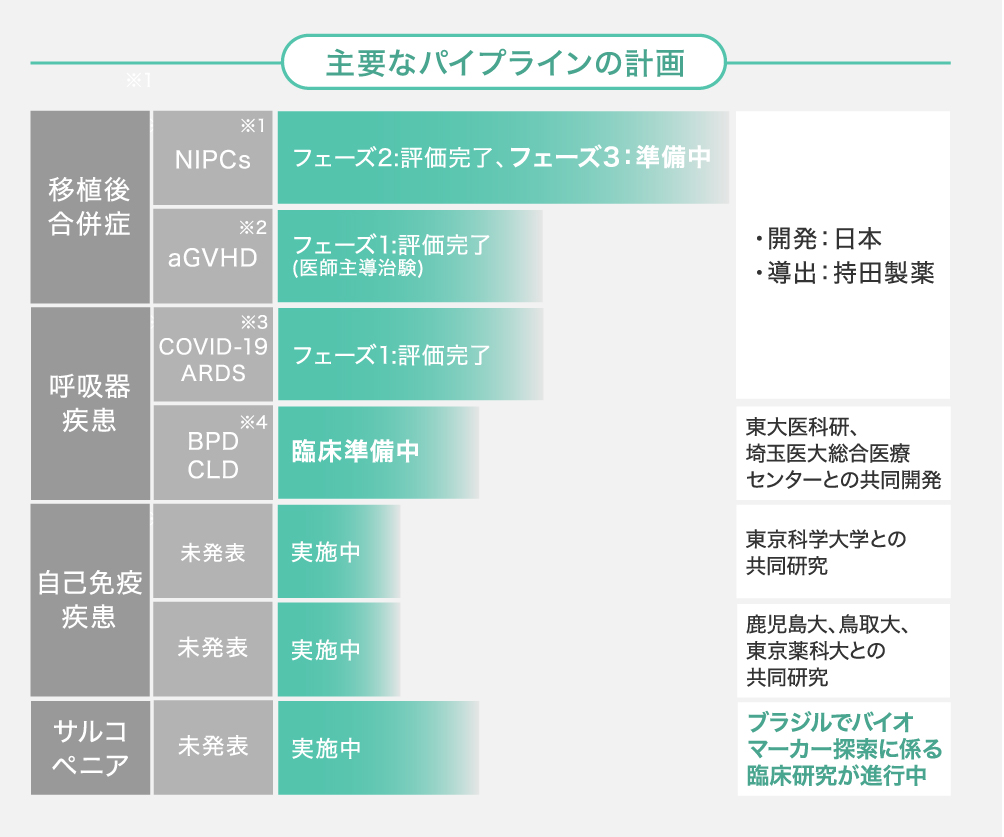
臍帯由来MSCsとして世界初・Phase3開始が目前に
 ※1 造血幹細胞移植後の非感染性肺合併症
※2 造血幹細胞移植後の急性移植片対宿主病
※3 新型コロナウイルス感染症に伴う急性呼吸窮迫症候群
※4 新生児慢性肺疾患
※1 造血幹細胞移植後の非感染性肺合併症
※2 造血幹細胞移植後の急性移植片対宿主病
※3 新型コロナウイルス感染症に伴う急性呼吸窮迫症候群
※4 新生児慢性肺疾患
現在、弊社が開発を進めるヒト臍帯由来間葉系間質細胞製剤「HLC-001」は、既に国内5つの医療機関で実施された、NIPCs(造血幹細胞移植後の非感染性肺合併症)を対象としたPhase2(臨床試験)を完了しており、安全性・有効性ともに一定の成果を確認しています。
■HLC-001のトピック
- 従来療法による生存割合24.5%を大きく上回る71.4%が確認され、Phase2試験結果が2025年7月に国際学術誌に掲載
- 2025年7月、厚生労働省「希少疾病用再生医療等製品」に指定。承認に向けての優先審査や、開発費の一部助成を受けることが可能に
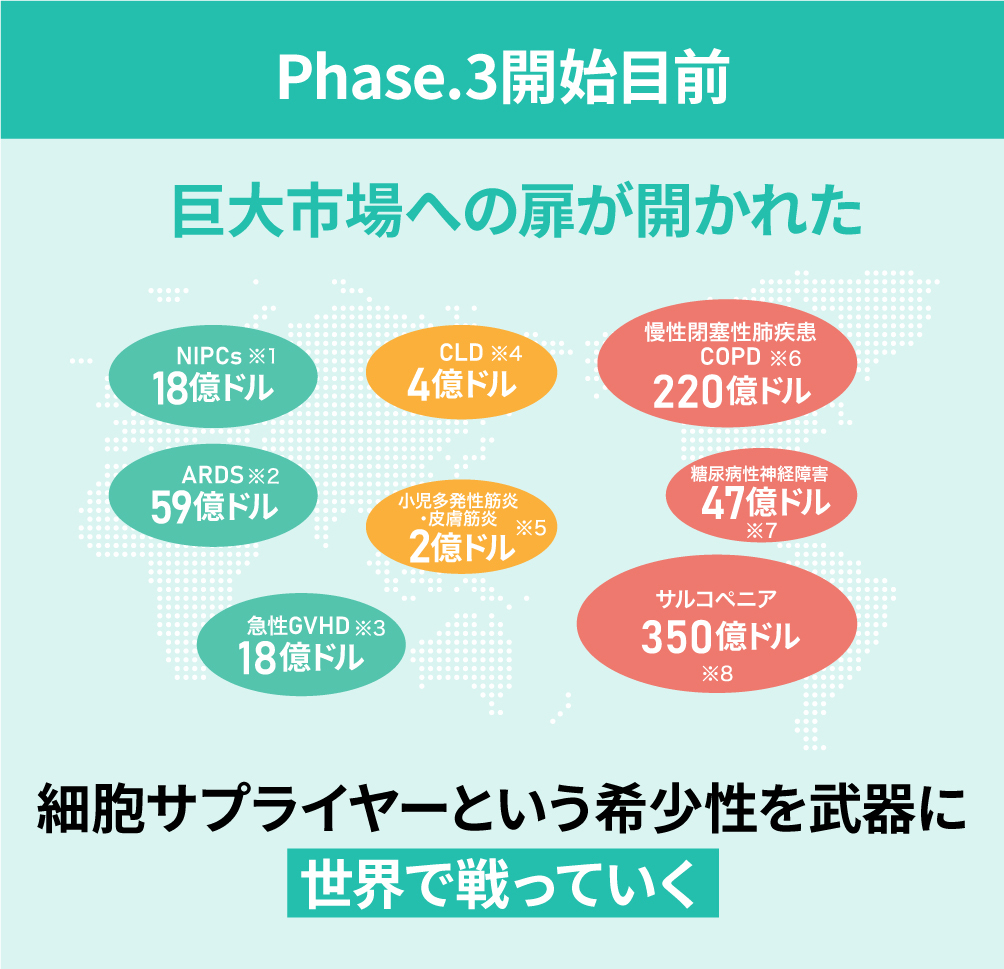
巨大慢性疾患市場への適応拡大へ
また今後は
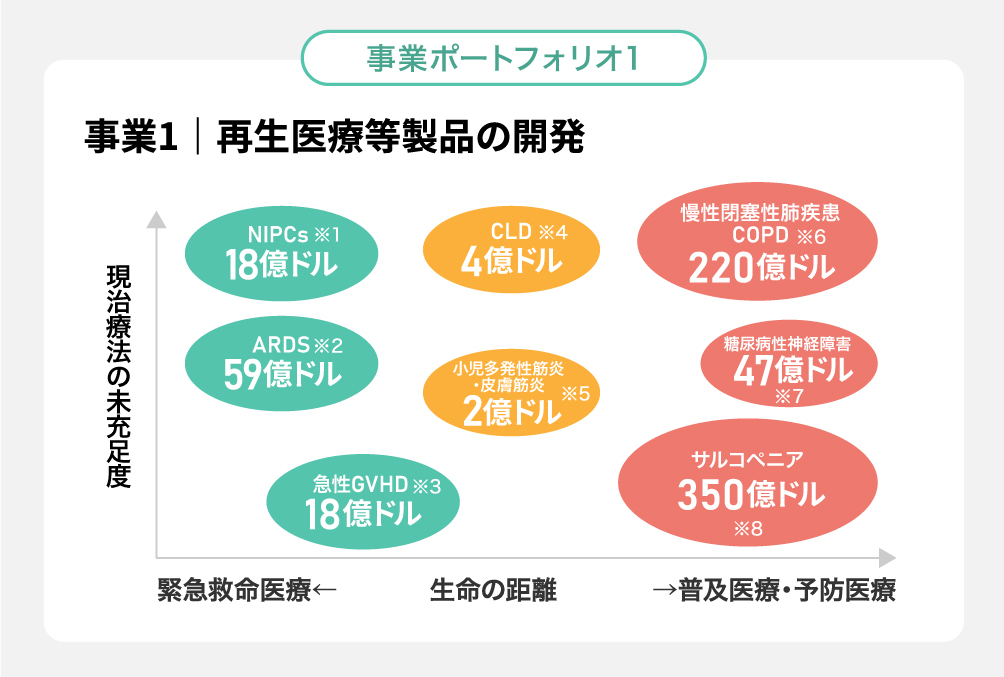
- ARDS(急性呼吸窮迫症候群):世界で110万人以上が罹患※1
- 糖尿病性合併症:国内で500万人以上、世界では1.7億人以上が罹患※2
- サルコペニア:明確な統計数値はないが、国内で約500万人、米国で約1,500万人、世界では少なくとも約1億人と推計
など、市場の大きな疾患を対象とした新たなパイプラインの拡大も計画しています。
既に複数の大学や医療機関との共同研究を通じて、基礎研究・臨床研究の足場が整いつつあり、中長期的な成長の核となる疾患領域の多角化が進行しています。
その他、「MSCs」から分泌される細胞外小胞(エクソソーム)のサルコペニア治療応用の可能性に関する研究成果が、国際学術誌に掲載され、有用性を示す新たな知見となりました。
※1 出典:米国・欧州・中国の統計の合算値。米国:Diamond M et al. 2023 Feb 6. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–.PMID: 28613773欧州:Community Research and Development Information Service (CORDIS) 2020 7-9
中国:song-et-al-2014-acute-respiratory-distress-syndrome-emergingresearch-in-china ※2 出典:国際糖尿病連合(IDF)
代表による事業の説明動画(創業の想い)
今後の展開
特定のパイプラインに依存しない事業モデルを構築
今後の最優先は、現在開発中のNIPCsに対する細胞治療製品「HLC-001」の製造販売承認の取得と商用化です。承認後は、臨床実績と製造・流通基盤を武器に、ARDSや希少・加齢性疾患へ適応拡大し、飛躍的な事業価値向上を図る計画です。また、東京大学との共同研究で生まれた技術に関しては、グローバルでの独占ライセンスのもと、世界への細胞供給・製法ライセンス事業として展開していくことを計画しています。
事業1|再生医療等製品の開発
疾患と対象顧客に基づき、「保険収載を獲得する製品(希少疾患・小児疾患向け)」と「保険収載によらず自由診療(検証型)の中で展開する製品(老化関連疾患・予防医療)」を使い分け
 ※1 CIBMTR、フロンティアズ・オンコロジー誌などの調査データによる推定患者数をもとに弊社が算出
※2 SkyQuest
※3 ResearchAndMarkets / Grand View / FMI
※4 Future Market Insights(FMI)
※5 DelveInsight
※6 Polaris Research
※7 FRAND VIEW RESEARCH
※8 The Business Research Company
※1 CIBMTR、フロンティアズ・オンコロジー誌などの調査データによる推定患者数をもとに弊社が算出
※2 SkyQuest
※3 ResearchAndMarkets / Grand View / FMI
※4 Future Market Insights(FMI)
※5 DelveInsight
※6 Polaris Research
※7 FRAND VIEW RESEARCH
※8 The Business Research Company
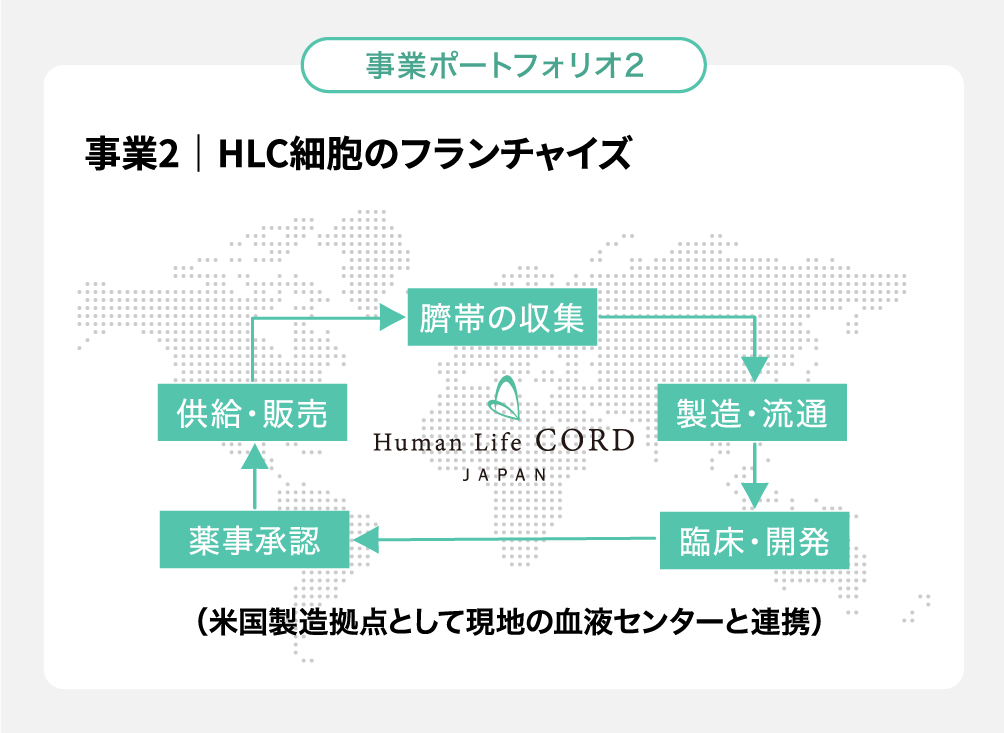
事業2|HLC細胞のフランチャイズ
弊社が持つ製品細胞の製法、評価法、保存法、製造用資材を含めたサプライチェーンシステムを各国の現地企業にライセンス(または合弁事業として)展開
※ IPO時期はFUNDINNO取扱時における発行者の計画であり、IPOの実現が確約されたものではありません。未上場株式の価格が変動することによって、価値が消失する等、その価値が大きく失われるおそれがあります。投資に関する決定はお客様ご自身のご判断と責任のもと行なっていただきますようお願いいたします。なお、上記の投資先は特定投資家の方のみを対象としています。