【海外で9社が採用済】 がん、生活習慣病への切り札“クルクミン”の高吸収率を実現する京都大学発バイオベンチャー。新型コロナの臨床試験も実施中



プロジェクト概要
日本人の2人に1人が生涯で罹患するといわれる「がん」(出典:国立研究開発法人国立がん研究センター)。弊社には、副作用を最小限にとどめる抗がん剤を開発して、治療中の患者のQOL(Quality of life:生活の質、生命の質)を改善したいという思いがあります。
また、加齢やストレスあるいは生活習慣によってさまざまな不具合が現れる体の状態を、より健康なままでキープし、更なる劣化を抑制できる機能性を持った食品を開発し、人々の健康に貢献したいと考えています。
この目的を達成するために京都大学発のバイオベンチャー「株式会社セラバイオファーマ」を設立し、医薬品化を目指す「TBP1901」の研究開発と機能性食品「クルクルージュ」を開発提供しています。

現在は、天然ウコンの主成分である「クルクミン」に着目し、研究開発を進めています。
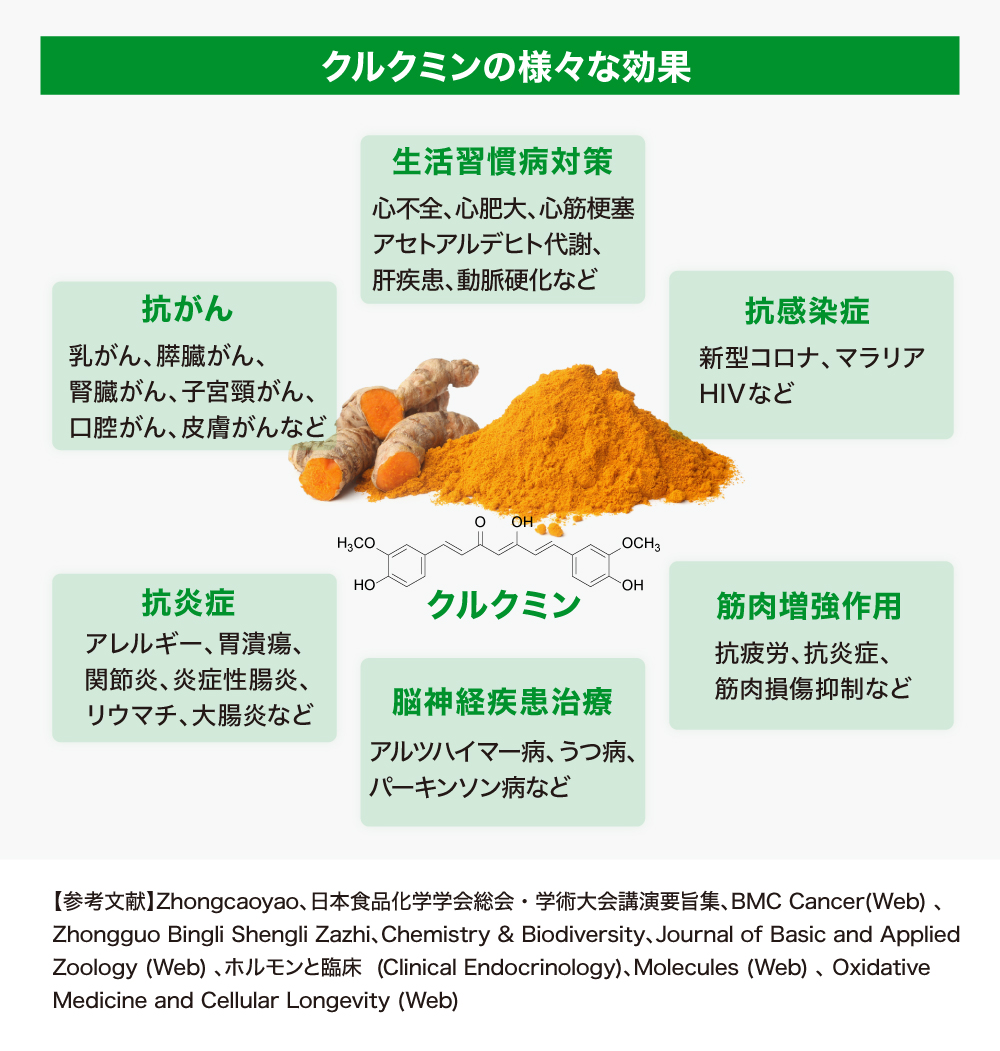
ウコンに含まれるクルクミンは、日本では二日酔いの予防作用が期待できることで有名ですが、実は、がんや生活習慣病、脳神経疾患をはじめとする多くの病気に効果があるという論文が数多く発表されています。

しかし、クルクミンは、ただウコンの粉末を口から摂取するだけではほとんど体に吸収されません。この課題を克服するため、弊社はクルクミンを吸収されやすくする独自の技術を開発し、機能性素材と医薬品研究開発という形で世の中に価値を還元しようとしています。
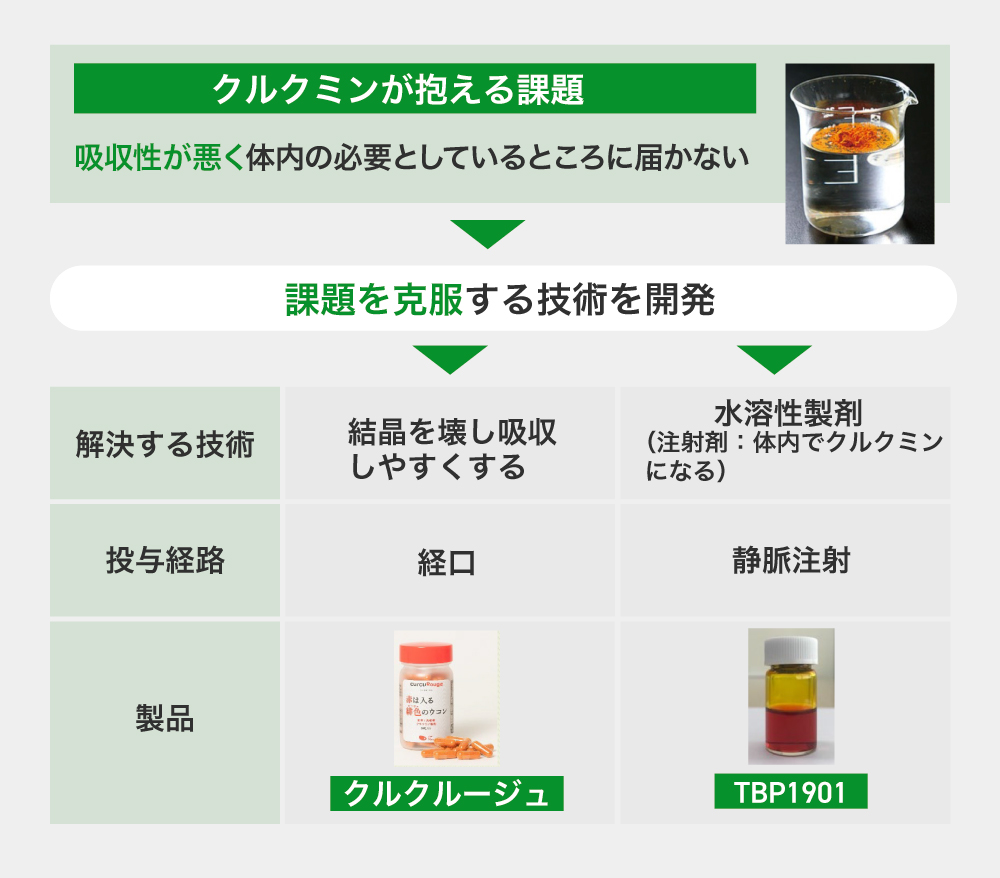
高吸収クルクミン製剤(食品)「クルクルージュ」は、クルクミンの結晶を壊れやすくする技術を用いており、吸収性を通常のクルクミンと比べて約100倍に向上させました。当原材料は、既にアメリカやヨーロッパを中心に世界に幅広く販売されています。
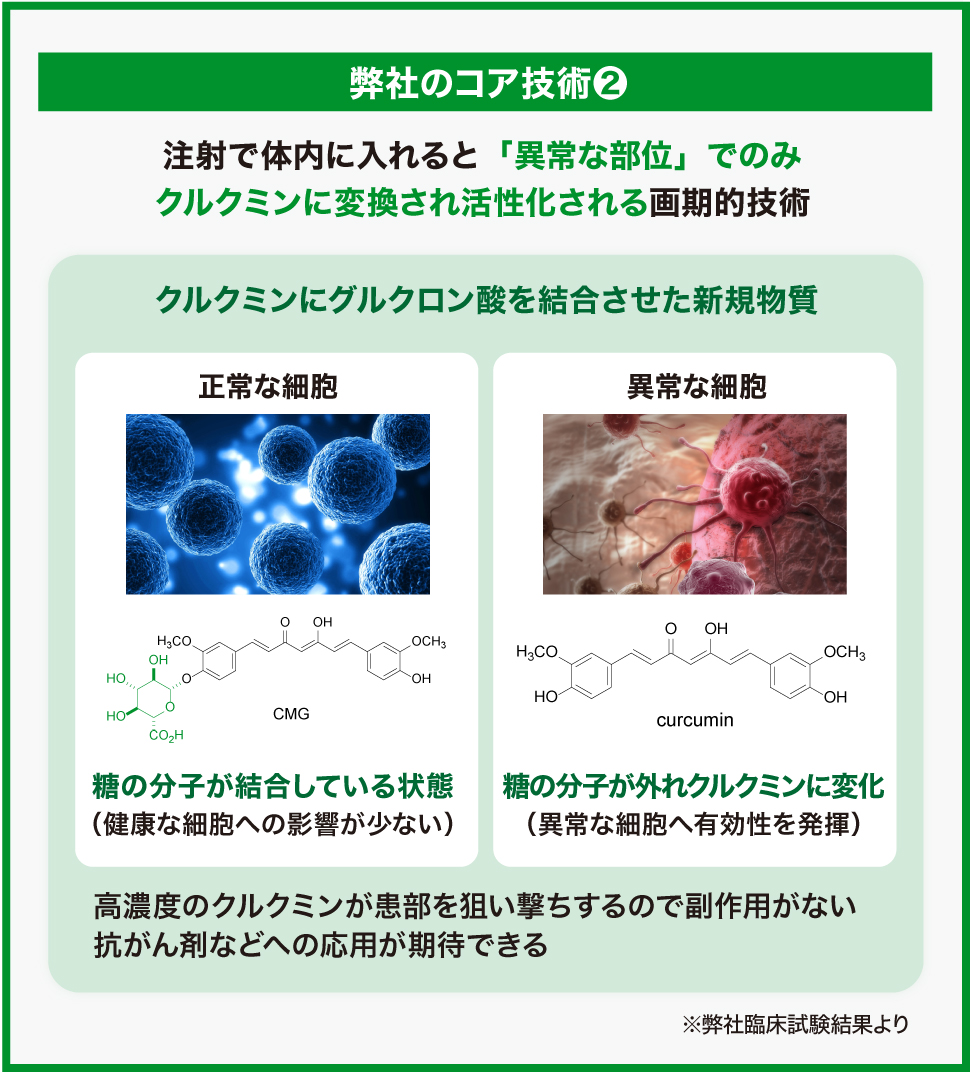
また、開発中の「TBP1901」は、クルクミン分子に糖を結合させて水に溶ける形にしたことで、直接静脈に注射することができます。疾患や炎症のある箇所でのみ糖が切り離されて元のクルクミンに戻るため、副作用のない抗がん剤などの医薬品としての社会実装を進めていく計画です。

「クルクルージュ」において、2020年3月から様々な臨床試験を実施しており、良い結果が得られれば世界中の人達の健康と豊かな生活に大きく貢献できると考えています。また、「TBP1901」においては、クルクミンの免疫機能正常化作用は、新型コロナの発症抑制や重症化予防にも効果があると考えられており、マウスによる研究では一定の効果が見られました。
▲クリックすると、動画をご覧いただけます。
弊社のコア技術
世界が注目。がんや生活習慣病にも効果が期待できる活性成分「クルクミン」を吸収しやすくする独自技術
「クルクミン」は、天然ウコンに含まれる活性成分で、残念ながら日本では二日酔い予防の粉末やドリンクとしてしか有名ではありません。しかし、クルクミンの効果はそれだけではありません。
欧米では抗酸化作用と抗炎症作用のあるサプリメントとして知られ、がんや生活習慣病、脳神経疾患、感染症等、さまざまな疾患への有効性が、数多くの論文で発表されています。抗酸化作用による免疫力増強効果で感染症の発症や重症化を抑制する有効性も確認されており、新型コロナへの対抗策としても世界中から期待されています。
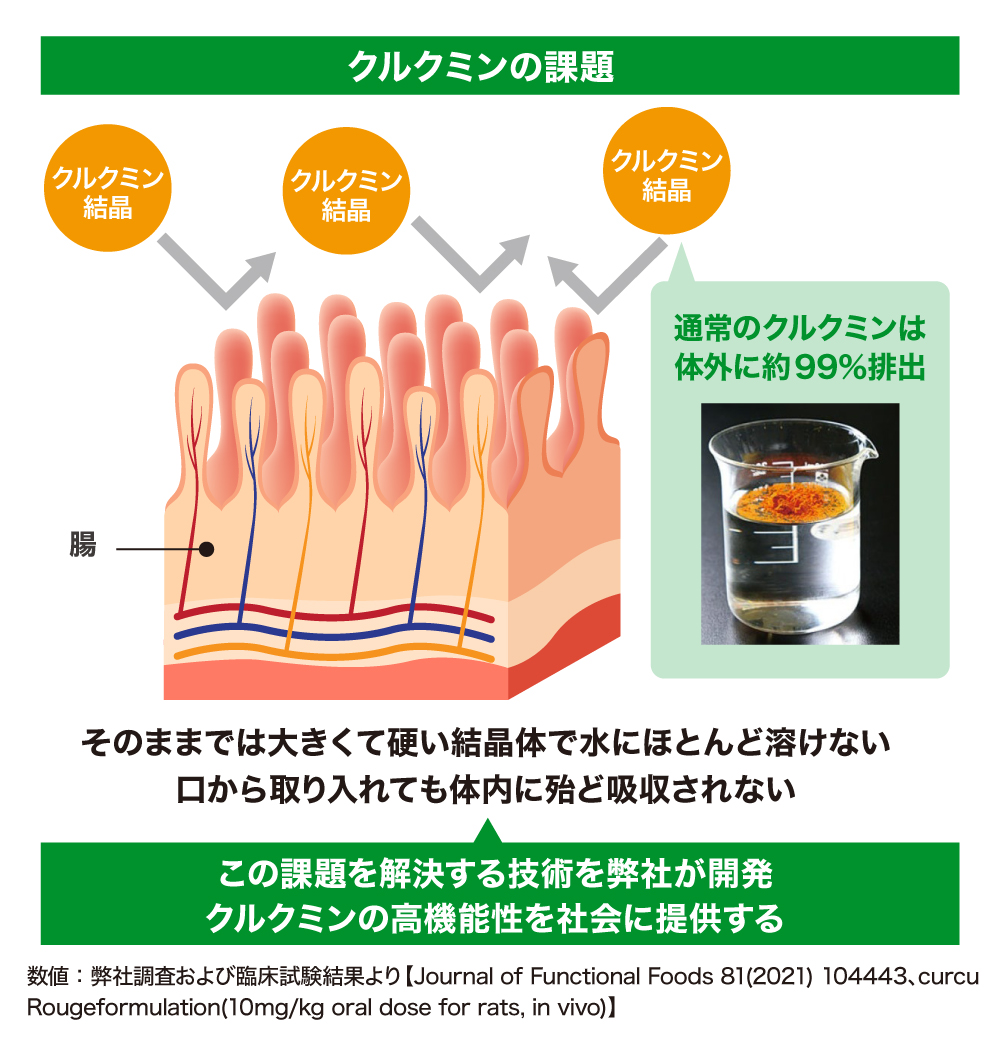
これだけ注目され、世界的に研究が行われているにも拘わらず、未だクルクミンは本格的な実用化には至っていません。その原因は、そのまま食べてもほとんど体に吸収されないという特性にあります。
ウコンから抽出したクルクミンは大きくて硬い結晶体で水にほとんど溶けません。口から摂取しても腸から吸収されにくく、約99%がそのまま体外へ排出されてしまうのです。クルクミンを体内の病巣や炎症部位に届けて効果を発揮させるには、この課題を解決する必要があります。
そこで、弊社は2つの方向からこの課題に向き合い、独自の技術を開発しました。
1.結晶を崩して吸収されやすくする(「クルクルージュ」に応用)
2.クルクミンに糖を合成して水に溶けるようにすることで、静脈注射による投与を可能にした(「TBP1901」に応用)
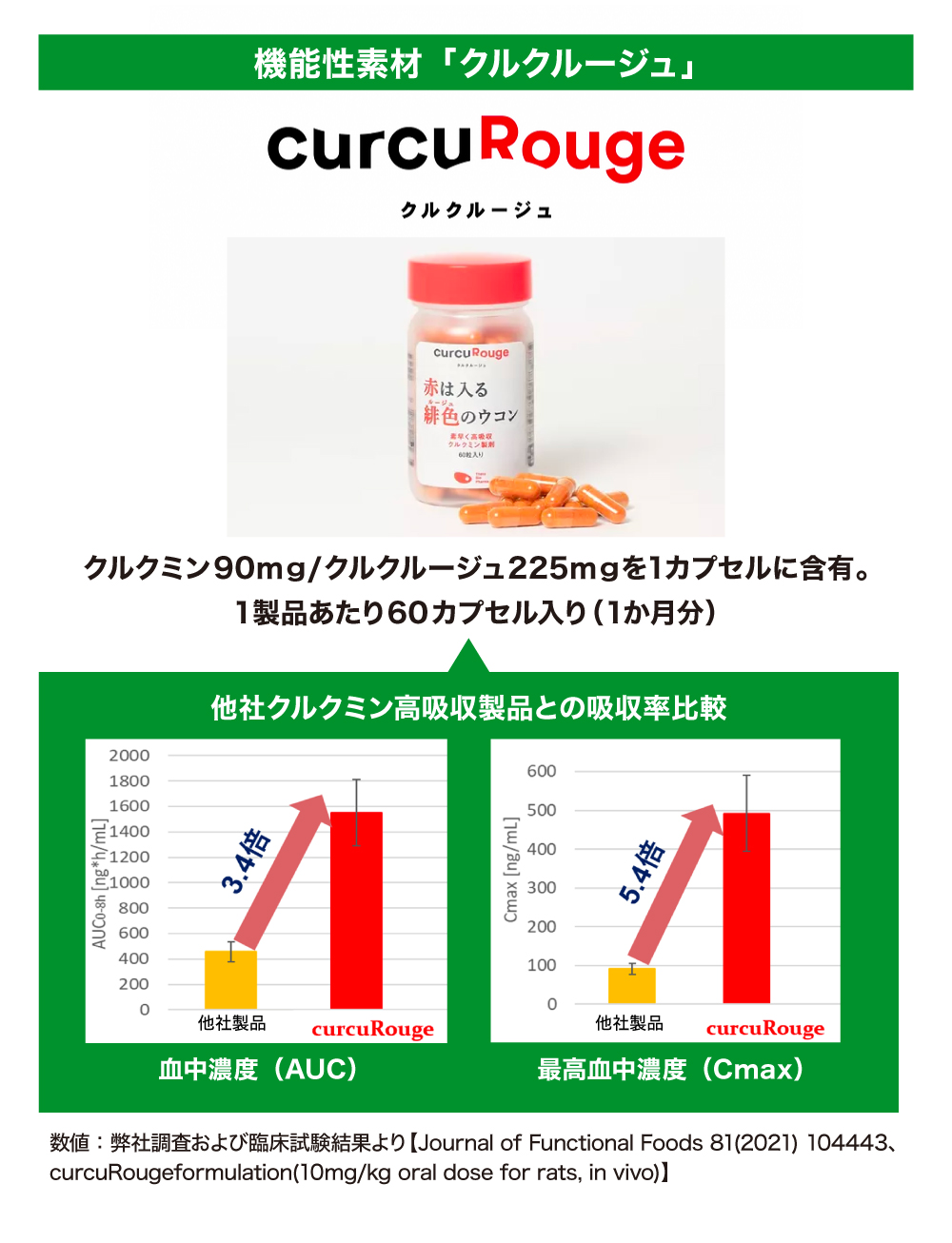
クルクミンの吸収率を約100倍にしたサプリメント「クルクルージュ」
通常のクルクミンは、分子が規則正しく並び大きく硬い結晶体になっていて壊れにくくなっています。この結晶体の構造を崩してアモルファス(非晶質)にすることで、分子がバラバラになりやすく吸収されやすい状態にする画期的技術、アモルファス化テクノロジーを開発しました。

この技術を利用して開発されたのが、機能性素材「クルクルージュ」です。「クルクルージュ」の吸収率は通常のクルクミンと比較して約100倍、市販の高吸収品と比較しても5倍以上となっています。
既に「クルクルージュ」を用いた臨床試験はいくつか実施し、その結果は論文化されており、さらに今後も様々な臨床試験を進めていく計画です。
「クルクルージュ」は、カプセルに詰めて手軽にとれるサプリメントとして販売を開始しています。
副作用を最小限にとどめる抗がん剤・新型コロナ治療薬などの医薬品化を目指す「TBP1901」
クルクミンに糖を合成して水に溶けるようにすることで、静脈注射による投与を可能にしたのが「TBP1901」(開発番号)です。
体内に入った「TBP1901」は、体内の健康な細胞にはほぼ影響を及ぼしません。炎症を起こしている患部に到達すると酵素によって糖との結合が切られて元のクルクミン分子に戻り、さまざまな効果を及ぼします。この酵素は炎症を起こしている箇所を中心に存在します。
がんは日本の死亡原因の約3割を占め、日本人の2人に1人が生涯でがんに罹患すると言われています(出典:国立研究法人国立がん研究センター)。抗がん剤はその治療に大きく貢献していますが、その副作用が患者のQOLを大きく下げてしまうのも事実で、副作用の度合いによっては使用を中止せざるを得ないケースもあります。
がん治療に使用されている抗がん剤に強い副作用があるのは、がん細胞の増殖を抑えて死滅させる効果が「健康な細胞」にも及んでしまうからです。「TBP1901」は、患部に到達するまでは糖と結合しており、この状態では健康な細胞に影響を及ぼすことがありません。つまり、副作用を最小限にとどめると考えられています。

副作用を最小限にとどめるがん治療薬はQOL向上につながると同時に、これまで抗がん剤を使用できなかった患者にも治療の道を拓くことができると考えています。「TBP1901」は、薬剤耐性も出にくいので、完治が見込めるまで投与を続けることが可能だと考えています。
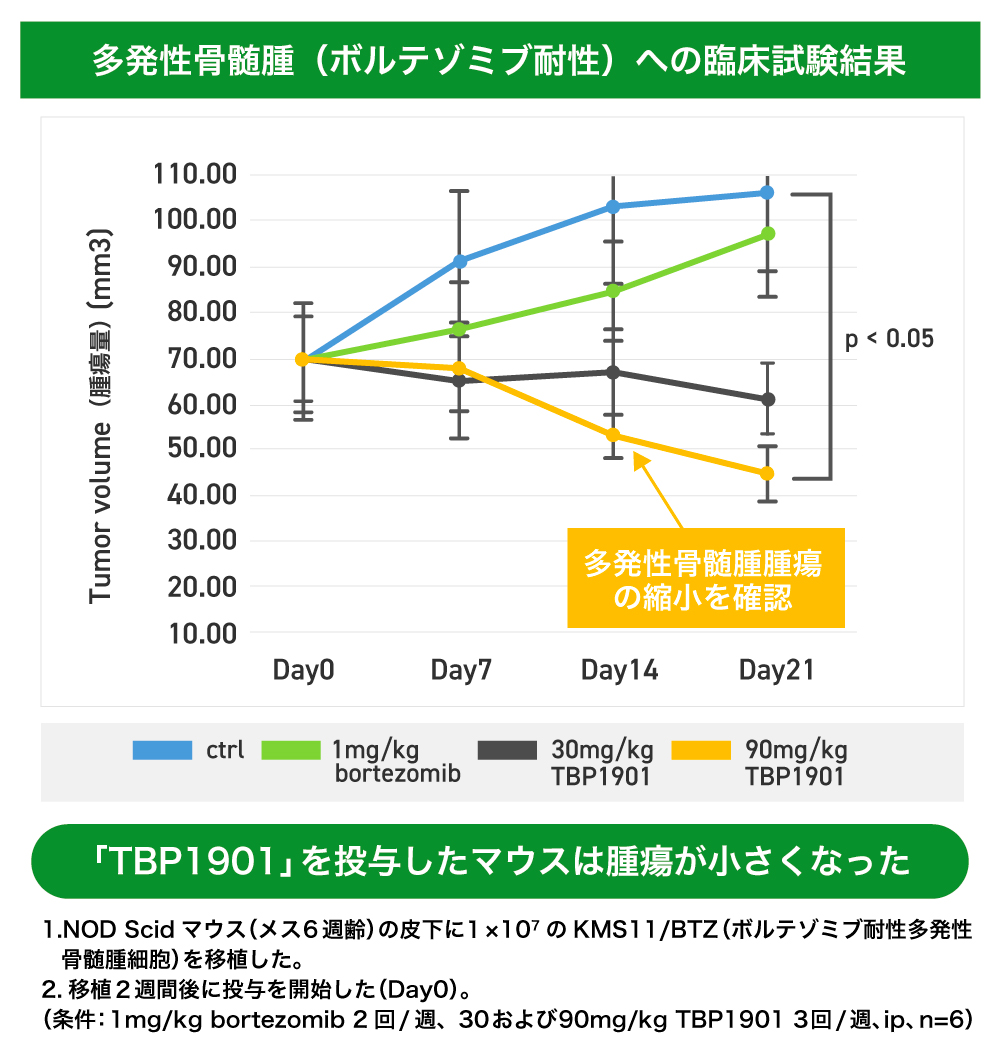
動物実験の段階ではありますが、骨髄のがんである多発性骨髄腫細胞を移植したマウスに「TBP1901」を投与したところ、腫瘍の縮小が見られました。そして、抗がん剤に耐性ができたがん細胞を移植したマウスに対しても効果が確認されています(研究結果一覧はこちらからご確認いただけます)。

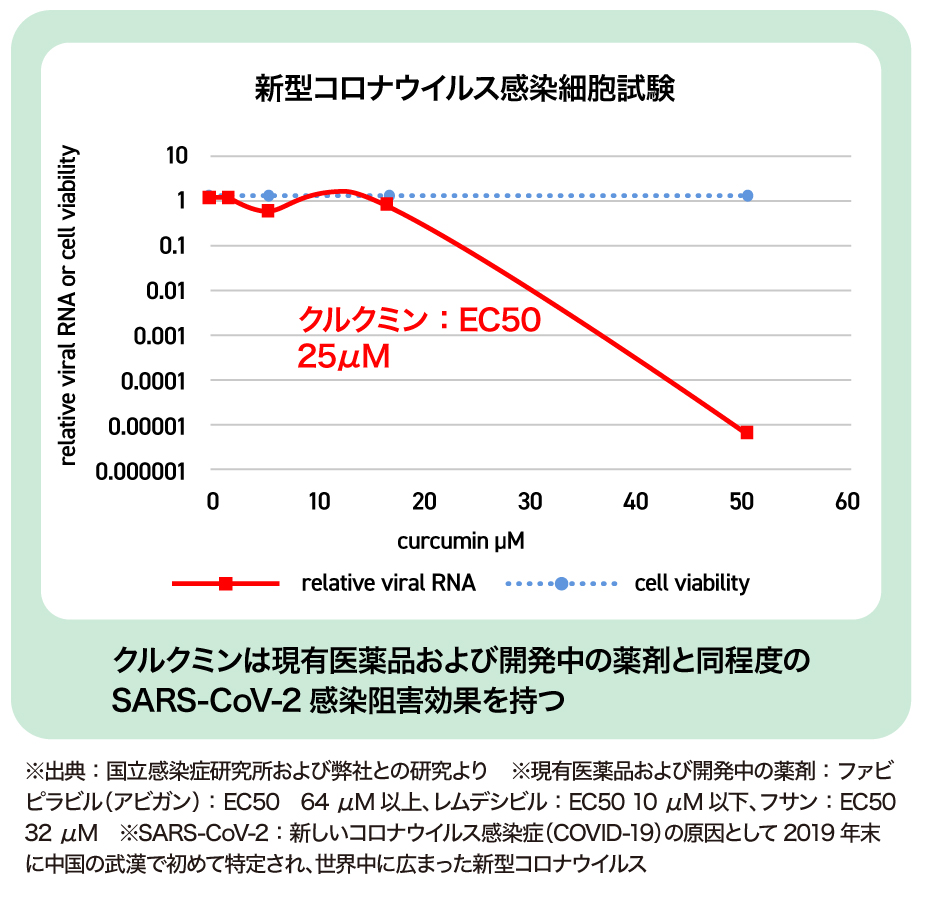
また、現在、新型コロナウイルス感染症の治療薬として用いられているもののなかにも、副作用のリスクが指摘されているものもあります。国立感染症研究所との共同研究では、クルクミンが現有医薬品および開発中の薬剤と同程度の感染阻害効果を持つことが示されました。その結果を得て、副作用のない新型コロナ治療薬としても活用していただけるように研究を進めています。
また、新型コロナウイルス感染症に対しては、「TBP1901」が細胞内へのウイルス侵入阻止・ウイルスの増殖阻止・炎症の緩和の作用があることが、マウスによる研究で確認されています。
そのため、感染予防の段階でも症状が出てからでも、どの段階で投与しても効果のあらわれる治療薬として提供できるように研究開発を進めています。

(※当章「こちら」から遷移するwebサイトは、FUNDINNOのものではありません)
ビジネス化の方法
「クルクルージュ」は世界各地の代理店が販売。クルクミン先進市場のアメリカやヨーロッパ、中国市場を中心に売上を伸ばす
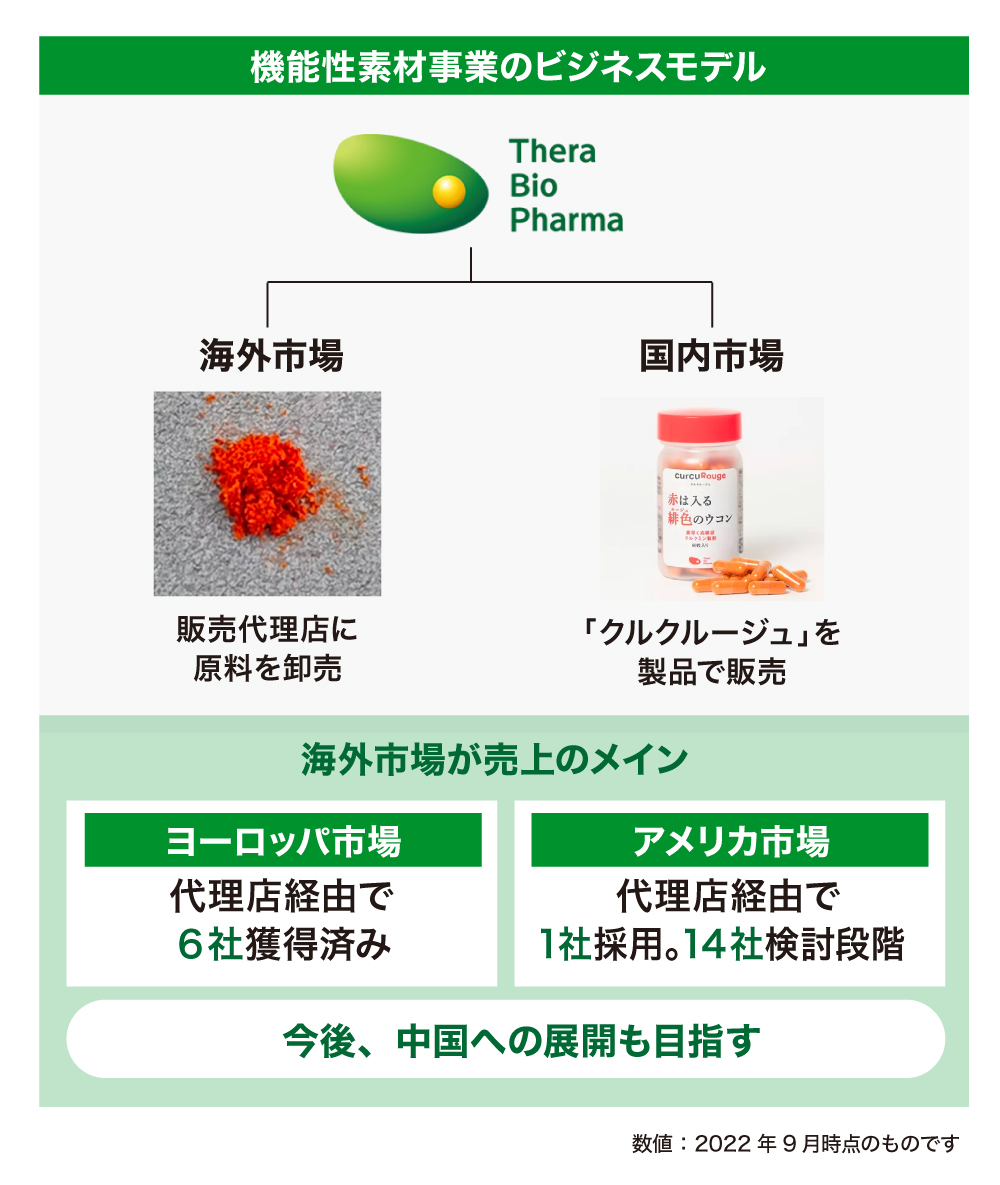
「クルクルージュ」は、2020年9月から販売を開始しており、アメリカやヨーロッパを中心に世界で幅広く展開しています。サプリメントの原料を世界各地の販売代理店に提供し、現地の工場で最終製品への加工を行う形を取っています。
ヨーロッパやアメリカでは、総代理店として活発に営業・マーケティング活動を推進してくれている大手香料・食品素材メーカーが、既にフランスやドイツで6社の顧客を獲得しました。さらに、今年度よりアメリカでの営業活動も本格的にはじめ、既に1社が採用を決め、14社が本格的な検討の段階に入っています。その他の地域でも2社採用企業があります。
そして、市場規模の大きいアメリカ、ヨーロッパをはじめ、中国も重要な市場と捉え、中国での販売を開始すべく、現在、アプローチをしています。
また、2022年3月から新型コロナウイルス感染者に対する発症抑制効果や病状進行抑制効果の試験を行っています。まだ、試験段階ですが、良い結果が出れば全世界にとって明るいニュースになると考えます。
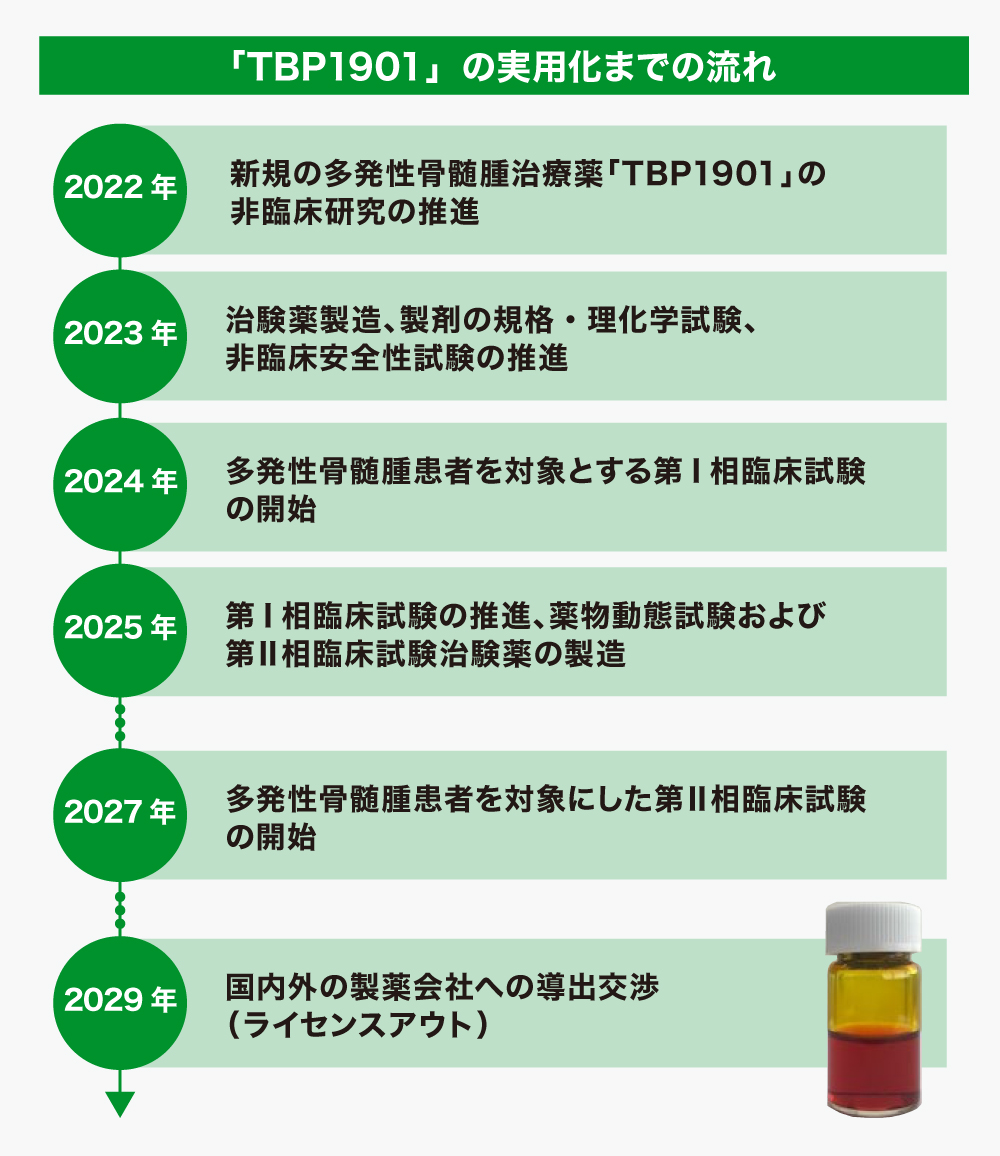
「TBP1901」は、安全性試験・臨床試験をクリアし、医薬品としての実用化を目指す
今後、安全性試験を実施し、それが完了次第、臨床試験に入る予定です。臨床試験は、京都大学の臨床試験センターで実施することが予定されており、その実施体制も整っています。
臨床試験での有効性が確認されたところで、世界の大手医薬品会社にライセンスアウト(販売権等の権利の使用許諾)する活動を開始する計画です。ライセンスアウトが決まれば、アップフロントやマイルストーンで発売前に大手製薬企業から数回にわたり数十億円以上のまとまった資金を得られる可能性があると考えています。
15年以上の研究で培った知識と技術。強力な支援ネットワークが強み
クルクミンを吸収しやすくする弊社の独自技術は、いずれも特許出願済みです(一部取得済み)。がん・脳腫瘍・新型コロナウイルス・変形性膝関節症の治療に「TBP1901」を用いることに対する用途特許も出願済みです。
弊社の研究チームには、通算15年以上クルクミンの研究・開発を行ってきた経験と実績があります。他にも、細胞レベルの基礎研究から製剤の開発まで、各分野に精通したメンバーが揃っていると自負しています。
京都大学をはじめとして、国内外で30以上の大学や研究機関とネットワークが有り、他にはない強力な研究・臨床試験支援の体制を持つことが弊社の強みです。

今後の成長ストーリー
弊社の技術をベースに、全世界を対象に、加齢、ストレス、肥満が原因の慢性病を予防し健康的な老化を実現したい
現在、進行中の臨床試験の他、弊社機能性素材の、うつ状態・気分の落ち込み、肝機能障害への効果の有用性についても臨床試験を予定しています。また、免疫機能の維持・改善効果について、機能性表示食品の届出を行うことを検討しています。臨床試験で認知機能の維持・改善効果が確認できれば、そちらも届出を行いたいと考えています。

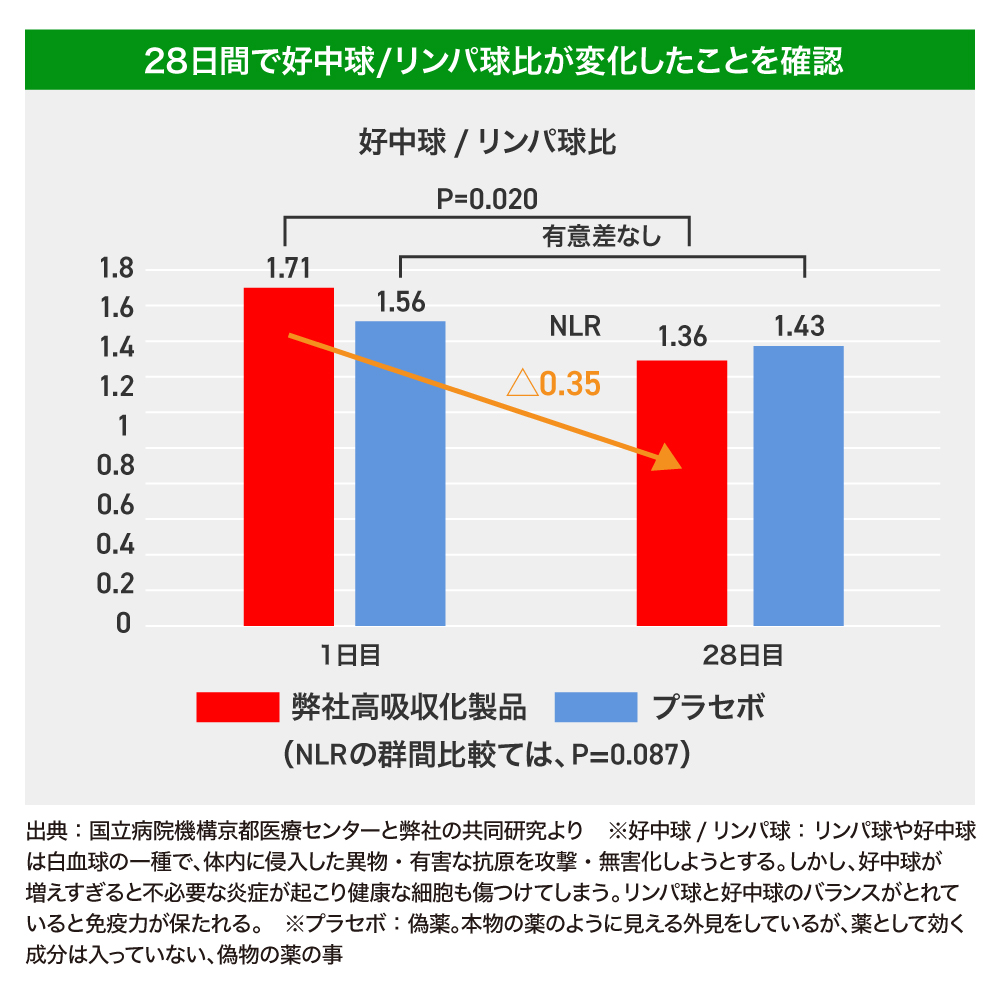
加齢やストレス、生活習慣等により免疫のバランスが崩れることで、ミエロイド系(骨髄系)の免疫細胞を過剰に作り、リンパ系が少なくなりやすくなります。この免疫の劣化を調整してくれる可能性があるのがクルクミンです。クルクミンを高吸収化した弊社開発商品において、臨床試験にて好中球/リンパ球比の改善を確認しました。
現在、世の中であまり知られていないクルクミンの効果・効能をひとつひとつ確認し、機能性食品として日常に浸透させ社会実装することで、世界の人々がその力を享受できると考えています。
クルクミン以外の有効成分の発見にも積極的に取り組み、新たな価値創造を
大きなポテンシャルを持った自然素材は、クルクミン以外にも存在する可能性があります。クルクミン研究での経験と事業基盤を活かし、新たな有効成分の発見にも弊社は取り組みたいと考えています。
漢方薬や健康食品として知られているものや、地中海ダイエット(地中海沿岸地域の食生活を取り入れたダイエット法のこと)等の食物を用いた健康法の中にヒントがあるのではないかと推測しています。クルクミンの発見につながったのも、インドの伝統的医学(アーユルヴェーダ)で用いられた生薬でした。
天然素材の潜在力で人々の健康を支えるため、新たな価値創造にも積極的に取り組んでまいります。

マイルストーン:将来のExitはIPOを想定
下の表は現時点において今後の経営が事業計画通りに進展した場合のスケジュールです。そのため、今回の資金調達の成否、調達金額によって、スケジュールは変更となる場合がございますので、予めご了承ください。また、売上高は事業計画を前提としており、発行者の予想であるため、将来の株価及びIPOなどを保証するものではありません。
【機能性素材事業】ヨーロッパ市場の開拓は、専属代理店であるフランスの大手企業を通じてサプリメントメーカーへ拡販中で、現在、フランスやドイツの6社が既に販売中です。今年度は、アメリカ市場に本格的に参入する計画です。既に1社が採用を決め、14社のサプリメント企業が採用を前提に検討しています。その他の地域でも2社採用企業があります。また、海外での事業拡大のために必要な臨床試験の実施を計画しています。
【医薬品研究開発事業】注射剤「TBP1901」は、その特性を考慮して、再発型の多発性骨髄腫治療薬としての開発を目指しています。GLP(Good Laboratory Practice(優良試験所規範))安全性試験の実行を計画しています。
【機能性素材事業】アメリカでのビジネスの更なる拡大を計画しています。同時に、中国市場への進出に向けた準備として、適切なパートナーの決定や、中国食品規制当局の許可取得に向けた作業を開始する計画です。また、海外で販売可能な新しい機能性素材の開発を本格的に開始する予定です。
【医薬品研究開発事業】2024年度の臨床試験開始を目指し、非臨床研究を推進することを目指します。具体的には、GLP安全性試験(4週間反復投与)、GMPで製造済みの「TBP1901」原薬を用いた治験用注射剤の製造と理化学・規格試験を行う計画です。また、抗腫瘍作用の特性を遺伝子レベルで解明するためCRISPR技術(遺伝子改変技術の一種)を用いた研究を京都大学と共同で進める計画です。
【機能性素材事業】中国市場に対する本格的な事業展開を、パートナーと共に実施する計画です。同時に、アメリカ市場の需要に十分対応できる生産能力を確保するための準備を開始し、生産体制を強化する予定です。
【医薬品研究開発事業】非臨床研究の成績を纏め、多発性骨髄腫患者を対象にした第I相臨床試験開始を目指します。臨床試験は京都大学医学部を中心に実施する計画です。
【機能性素材事業】引き続き市場の開拓と事業基盤の確立のため、「クルクルージュ」及びその他の機能性素材の優位性をアピールし、健康食品メーカーなどへのアプローチの強化及び、それらの力の証明のための臨床試験を実施する予定です。
【医薬品研究開発事業】多発性骨髄腫患者を対象にした第Ⅰ相臨床試験を継続し、有効性や安全性の確認、また「TBP1901」の抗がん剤としての特性の確認を目指します。また京都大学と共同で、「TBP1901」のラベル化合物(化合物中の特定の原子における同位体組成を天然のものとは変えて合成される化合物)を合成し、薬物動態研究を行うとともに、第Ⅱ相臨床試験の治験薬製造等の試験準備を進める計画です。
【機能性素材事業】生産工程や購買、輸送作業等の見直しや効率化を進めていくことでコストや経費の削減をはかり、価格競争力を向上させていく予定です。また同時に、これらの効率化を通じて製品の品質管理の向上を実現するとともに、次世代の製剤技術の開発を推進する計画です。
【医薬品研究開発事業】第Ⅰ相臨床試験の継続を計画しています。
【機能性素材事業】クルクミン及びそれ以外の機能性素材の全世界での売上増強と、地域や市場セグメントのカバレッジ(網羅率)の増大を目指します。
【医薬品研究開発事業】多発性骨髄腫患者を対象にした第Ⅱ相臨床試験を実施し、有効性や安全性の確認、また臨床用量や用法の決定を目指します。また、「TBP1901」は薬剤耐性大腸がんや神経膠芽腫などの難治性がんに対する有効性も期待できるため、そのような患者を対象に臨床試験を計画し、適応拡大を目指します。
【医薬品研究開発事業】引き続き、多発性骨髄腫患者を対象にした第Ⅱ相臨床試験を実施することを計画しています。
【医薬品研究開発事業】前年度までに取得した臨床試験や非臨床研究のデータを用い、国内外の製薬会社への導出交渉(ライセンスアウト)を進め、本年度内の導出契約締結を目指します。
「▶︎ボタン」をクリックすると各年度目標の詳細をご確認いただけます。
また、上記のサービス追加は、今回の資金調達に伴って行われるものではなく、今後、新たな資金調達を行うことによる追加を計画しているものです。なお、新たな資金調達の方法は現時点において未定です。
KPI:2030年までに20t以上の機能性素材(クルクルージュ)の年間販売を計画
下記のKPIの推移については、事業計画書(売上高など推移予想)の内容を反映しております。なお、KPIの推移については、発行者の予測であり、必ずしも保証されるものではありません。事業計画書につきましては契約締結前交付書面の別紙1-1・別紙1-2をご確認ください。
チーム/創業経緯/株主構成など
研究開発とネットワークに強みを持つ人材と財務のエキスパートの集合体
弊社代表の橋本は、長年にわたる天然素材、特にクルクミンの研究と開発を通じて、多くの研究、教育、及び医療機関とのネットワークを構築しています。加えて、研究開発や財務・経理、生産を長く経験してきたスタッフからの協力のみならず、社外からも様々なサポートを受けています。
チーム

京都大学工学部卒
【歴任】
大塚製薬株式会社 米国子会社 副社長
日本コカ・コーラ株式会社 副社長
株式会社コカ・コーラ東京研究開発センター 社長
長年、天然素材の研究開発に携わってきた。その間、国内外の大学、研究機関及びサプリメント等製造会社との親密な関係を構築
クルクミンに着目し、事業化を進めるため、2016年に弊社を設立

帝人株式会社に入社後、医薬事業の立ち上げ時から参画し、研究開発・製造担当役員を歴任、大学、医薬品会社等との親密な関係を有する
弊社創業メンバー。理学博士

慶応義塾大学大学院理工学研究科博士課程修了
独立行政法人理化学研究所での副主任研究員を経て、現在、京都大学大学院薬学研究科教授及び独立行政法人理化学研究所 客員研究員(兼任)
弊社創業メンバー。工学博士

京都大学大学院医学研究科博士課程修了
京都大学医学部附属病院・医学研究科 臨床腫瘍薬理学 特定准教授
弊社創業メンバー。医学博士
創業のきっかけ
現代医学の不完全さがもたらす問題点の解消と、人々の生活の質の向上と健康的な老後生活のための技術開発

現代の医学は、西洋医学を中心に飛躍的な発展を遂げ、多くの人の疾病の治療や健康の維持に貢献してきていますが、分子レベルの研究を基に作られた医薬品の多く、特に抗がん剤においてはその効果を発揮するメカニズムから、治療に使った際に重い副作用などが伴うことは避けることができませんでした。
一方、クルクミンはウコンに含まれる有効成分のひとつですが、体内の様々な炎症を抑え、現代病を予防し健康を維持する効果があるとされており、その効果効能については、世界中で行われている数多くの研究で証明されています。
がんをはじめとする様々な現代病に対しての効果についても数多くの研究が証明しており、これらの研究の中で強調されていることは、クルクミンを用いた治療では、現代の医薬品が健康な細胞も同時に攻撃してしまうことで起こるような副作用や薬剤耐性が出にくく、このような問題点を解決できる可能性があることを強く示唆しています。
また、クルクミンは比較的安価に手に入れることができるため、病気の治療や予防のための医薬品だけでなく、普段の健康を維持するための機能性素材を作ることで、多くの人々が健康で健全な生活を謳歌でき、健康的な老後を過ごせるようになる一つの手段を全世界の人々に対し提供できるのではないかと考えています。
現代医学が抱える問題点の解決策の提供と、人々のあらゆる世代を通しての健康的な生活をサポートするために、この会社を創業しました。
メンターからの評価

日本人の高齢化が進む中で、健康寿命の延伸が重要であることは言うまでもありません。
日常の食生活が注目されていますが、セラバイオファーマ社は食物などの天然物に含まれる素材を活用した基礎研究を行い、独自の技術により健康維持に有用な機能性素材やサプリメントを開発しています。私はセラバイオファーマ社の製品である高吸収クルクミン製剤(商品名「クルクルージュ」)に興味を持ち、高齢者に摂取いただき、「クルクルージュ」が血液中の好中球数とリンパ球数の比率を低下させることを、二重盲検無作為化試験という厳密な方法で確認しました。
好中球数/リンパ球数の比率は、がん、感染症、心血管疾患など、加齢に伴う様々な病気の重症化や死亡の、大変重要な指標です。他の素材では見られない作用で、加齢に伴う様々な体調の変化に応用が可能な優れたサプリメントとして期待しています。
また、セラバイオファーマ社は、機能性素材の研究で培った技術を用い、ユニークな医薬品の研究開発にも取り組んでいます。機能性素材と医薬品のシナジーを活かし、バイオベンチャーであるセラバイオファーマは健康寿命の延伸や疾患治療に繋がる優れた製品を創出し、エビデンスを構築しつつ(信用性の高い証拠を集めつつ)あります。これらの製品が広がれば、国民の健康と福祉に大きく寄与することでしょう。

株式会社セラバイオファーマは天然素材の潜在能力を活用して、機能性素材と医薬品を研究開発している京大発のバイオベンチャーです。
機能性素材として、超高吸収クルクミン製剤「クルクルージュ」の開発に成功し、免疫機能の向上などがヒト臨床試験で証明されています。医薬品研究開発では、体内で活性体であるクルクミンを効率よく遊離することができる化学合成品「TBP1901」の創製に成功し、「TBP1901」は薬効メカニズムから判断して、抗がん作用、抗炎症作用など多様な疾病に効果を示す革新的医薬品になりうる可能性を秘めています。
科学と情熱に裏打ちされた「クルクルージュプロジェクト」や「TBP1901プロジェクト」などが加速度的に進展し、1日も早く患者様に届き、福音をもたらすことを強く期待しています。

クルクミンはカレーの香辛料としても使われている天然化合物です。クルクミンが抗がん作用を有することは多くの基礎研究で証明されていますが、経口投与では抗がん作用を発揮するのに十分な血中濃度が得られませんでした。
「TBP1901」は、体内でクルクミンに変換される合成化合物ですが、これを用いることによりクルクミンの抗がん作用を引き出すのに十分な血中濃度が達成できるようになりました。既存の抗がん薬に抵抗性を示すヒトの大腸がん細胞を移植したマウスに「TBP1901」を投与したところ、3週間後の腫瘍の大きさが治療しないマウスの半分以下に抑えられました。また、既存の抗がん薬を投与したマウスでは21日目に体重減少や白血球/赤血球/血小板減少、肝機能障害などの副作用を認めましたが、「TBP1901」を投与したマウスではこれらの副作用は認めませんでした。
これらの結果から、「TBP1901」は副作用の少ない、新しい抗がん薬としての開発が期待できると考えています。

株式会社セラバイオファーマが新しいクラウドファンディングでの資金調達を始めるとの事。大変たのしみだ。これまで先端医療の課題解決、具体的には副作用のない抗がん剤やコロナ重症化予防薬の開発・研究を引っ張ってこられた橋本正さんが、基礎研究の更なる充実、また付加価値を増大させるための臨床実験を拡充させるためにクラウドファンディングの仕組みを利用し資金を集めるというのだ。
橋本さんとは、京都大学の先輩後輩という間柄ではあるが、仕事的にはバイオの世界で創薬事業や機能性食品の開発に取り組んでこられた橋本さんと、マスコミ業界に身を置く私とは、直接的な仕事の接点はない。しかし、「健康に人生を楽しむために」という彼のポリシーのもと、15年以上研究開発を重ねてこられたクルクミンに興味を持ち、いろいろとお話を伺い、機能性素材開発の重要性、その大変さを教えられてきた。
今回のクラウドファンディングは、橋本さんが機能性食品や創薬業界に新たなイノベーションを引き起こすための次へのステップなだけに、是非成功させてほしいと願っている。

セラバイオファーマ社は弊社の幹細胞を利用した各種サービスとも色々な面で関連し、随時情報の交換や技術評価をお互いに実施しています。
生体での基本的な作用機構や、幹細胞の活性化と化合物関係等重要なテーマを妥協せずに掘り下げる姿勢にはいつも感心させられています。今後もそのサイエンス中心の姿勢を変えず、世界をリードするような研究と技術開発を極めて行って欲しいと思います。
それらの成果を社会実装するときに私どもの会社も貢献できると考えて、大きく期待しています。

(訳)
フレーバー&フレグランス業界の天然成分の世界的リーダーであるRobertet S.A.(ロベルテ)は、セラバイオファーマ社の設立以来のパートナーです。
セラバイオファーマ社の創設者兼CEOである橋本さんが開発した、バイオアベイラビリティ(生体利用効率)の高いクルクミンを食品サプリメント市場に投入することに成功しました。
170年の歴史を持つロベルテは、天然成分に関して比類なき専門知識を、広い範囲にわたって築き上げてきました。しかしながら、戦略的に必要な場合には、特定の分野における最高のパートナーを探すことを厭いません。
高吸収を謳うクルクミンは我々の市場ではよく知られていますが、その中でも橋本さんの幅広い知識とこの分野で最先端の技術を持つセラバイオファーマ社は、競合他社よりも際立っていると判断しました。
臨床研究の設計からデータ収集に至るまでの全プロセスにおいて、セラバイオファーマ社は、最高の素材を開発するために必要な、幅広い技術的専門知識にアクセスし、習得することが証明されています。
パートナーとして、私たちはチームと緊密に協力し、臨床研究に対する資金提供や緊密な情報共有を通して、最終的に2021年にヨーロッパで、2022年に米国市場でクルクルージュ原料の販売を開始しました。
個人的には橋本さんとは15年以上の知り合いで、いつも彼の科学(思考、知識)に感銘を受けています。人々のより良い生活を支援することを目的とした天然成分のアイデアについても、今までに何度も議論してきました。
ロベルテはセラバイオファーマ社の誇り高いパートナーであり、協力してクルクルージュの成功をさらに発展させ、将来的に他の分野での素材開発でも共に成功することを確信しています。
(原文)
Robertet S.A. world leader in natural ingredients for F&F industry, has been partner of Therabiopharma Inc. since its creation.
We have successfully cooperated to launch on the food supplement market, curcuRouge, a highly bioavailable curcumin designed by Mr. Tadashi Hashimoto, founder and CEO of Therabiopharma Inc.
170 years of experience makes Robertet S.A. natural expertise truly unique and extensive. However, strategically, we look for best in class partners for specific subjects.
Bioavailable curcumin is well known on the market but Therabiopharma Inc. appeared for us to stand out of the competition because of the extensive knowledge of Hashimoto San and the cutting edge technology available to them.
From the process involved to the clinical study design and data collection, Therabiopharma has proven to access and master a wide array of technical expertise aimed to design the best ingredients.
As partners we have worked closely with the team, financing clinical studies and sharing information to eventually launched curcuRouge in 2021 in Europe and 2022 on the US market.
Personally, I know Hashimoto San for over 15 years and have always been impressed by his science. We have also discussed ideas in the field of natural extracts aimed to help people to live better many time.
Robertet S.A. is a proud partner of Therabiopharma Inc. and we are confident to grow together the success of curcuRouge and develop in the future of other successful ingredients
株主構成
弊社は、事業会社およびエンジェル投資家より、出資を受けています。
(上記掲載のURLから遷移するwebサイトは、FUNDINNOのものではありません。)
メディア掲載実績
弊社は、メディア掲載実績があります。
プロジェクトにかける思い
自然素材の持つ潜在力を、健康を支える力に変えるための、基礎研究と臨床試験を加速させ全世界で社会実装する
▲クリックすると、動画をご覧いただけます。
そのままでは体内に殆ど吸収されないクルクミンを独自の技術で高吸収化した「クルクルージュ」は、非常に高い吸収性を持ちます。この素材を用いた臨床試験では、今まであまりクルクミンの効果として研究対象とされなかった、免疫機能の改善効果や感染症に対して有効性を発揮することが分かってきました。
しかも、「クルクルージュ」は安全で手軽な機能性素材なので、免疫や感染症に対する効果が確証され、そのメカニズムが解明されることで、多くの方が健康を維持したり、病気に罹りにくくすることに多大な貢献ができるものと確信しています。
よって、この素材の効果を最大限発揮させるための基礎研究をさらに加速させ、効果を証明する臨床試験を充実させる事で、クルクミンの持つ効果を、一日でも早く皆さんに届けたいという一心でこのプロジェクトを立ち上げました。
ぜひ、ご支援のほどよろしくお願いいたします。
その他
発行者情報
-
金融商品取引契約の概要
株式投資型クラウドファンディング業務として行う非上場有価証券の募集の取扱い
※ 詳しくは契約締結前交付書面「ファンディング・プロジェクトについて」をご確認ください。
-
募集新株予約権の発行者の商号及び住所、資本金等
株式会社セラバイオファーマ
神奈川県川崎市高津区坂戸三丁目2番1号KSPイノベーションセンタービル東604資本金: 223,066,736円(2022年8月8日現在) 発行済株式総数: 2,293株(2022年8月8日現在) 発行可能株式総数: 10,000株 設立日: 2016年8月25日 決算日: 3月31日 -
本新株予約権の発行者の代表者
代表取締役 橋本正
-
発行者における新株予約権の保有者に関する事項、および行使請求場所
株式会社セラバイオファーマによる株主名簿及び新株予約権原簿の管理
【連絡先】
電話番号:044-322-0005
メールアドレス:info@therabio.co.jp
企業のリスク等
株式会社セラバイオファーマ第1回FUNDINNO型有償新株予約権に投資するにあたってのリスク・留意点等の概要
※以下は株式会社セラバイオファーマ第1回FUNDINNO型有償新株予約権に投資するにあたってのリスク・留意点等の概要です。詳細については必ず契約締結前交付書面をご確認ください。また、一般的なリスク・留意点については 「重要事項説明書」をご確認ください。
新株予約権は、権利行使期間の終了までに株式に転換するための権利行使をしないまま権利行使期間が終了すると権利が消滅し、投資金額の全額を失うことになります。
募集新株予約権及び新株予約権を行使して取得した株式は、非上場の会社が発行する有価証券であるため、取引の参考となる気配や相場は存在しません。また、換金性も著しく劣ります。
発行者の発行する新株予約権及び新株予約権を行使して取得した株式には譲渡制限が付されているため、店頭取引が行われたとしても、譲渡による取得について発行者による承認が得られず、新株予約権者及び株主としての権利移転が行われない場合があります。
募集新株予約権及び新株予約権を行使して取得した株式は、金融商品取引所に上場されておらず、その発行者は、収益基盤が確立されていないことなどにより財務体質が脆弱な状態となっている場合もあります。当該発行者等の信用状況に応じてご購入後に価格が変動すること等により、損失が生じることや、その価値が消失し、大きく価値が失われることがあります。
募集新株予約権は、社債のように償還及び利息の支払いが行われるものではなく配当は支払われません。また、新株予約権を行使して取得した株式について、配当が支払われないことがあります。
募集新株予約権について、金融商品取引法に基づく開示又は金融商品取引所の規則に基づく情報の適時開示と同等程度の情報開示は義務付けられていません。
有価証券の募集は、金融商品取引法第4条第1項第5号に規定する募集等(発行価額が1億円未満の有価証券の募集等)に該当するため、金融商品取引法第4条第1項に基づく有価証券届出書の提出を行っていません。
発行者の財務情報について、公認会計士又は監査法人による監査は行われていません。
発行者は前期決算期末(2022年3月31日)及び直近試算表(2022年6月30日)において債務超過ではありません。今後、売上高が予想通りに推移しない場合、債務超過に陥るリスク及び有利子負債の返済スケジュールに支障をきたすリスクがあります。
発行者の前期決算期末(2022年3月31日)及び直近試算表(2022年6月30日)において営業損失が計上されています。今後、売上高が予想通りに推移しない場合、営業損失が継続するリスクがあります。
今後の市場動向及び市場規模など不確実性を考慮した場合、競合他社の参入等により当該会社の市場シェアの拡大が阻害され収益性が損なわれるリスクがあります。
発行者の設立日は2016年8月25日であり、税務署に提出された決算期(2022年3月31日)は第6期であり、現在は第7期となっています。 上場企業等と比較して銀行借入等による融資や各種増資について円滑に進行しない可能性があります。 発行者の資金調達計画(今回の募集新株予約権の発行による増資を含む)が想定通りに進行せず、事業拡大に必要な資金が調達できない場合、事業計画及び業績に影響を及ぼす可能性があります。発行者は当募集において目標募集額を1,008万円、上限応募額を4,032万円として調達を実行します。 但し、現時点では上記資金調達が実行される保証はありません。なお、発行者は当募集後、2023年1月に不足分の資金調達を予定(※ただし、今回の資金調達により上限応募額に到達した場合は、2023年1月の不足分の調達は行わない予定です。)していますが、売上実績が想定どおりに進まない場合には予定している資金調達に悪影響を及ぼし、今後の資金繰りが悪化するリスクがあります。
発行者は創業以来、配当を実施していません。また、事業計画の期間に獲得を計画しているキャッシュ・フローは事業拡大のための再投資に割り当てる計画です。そのため、将来的に投資家還元の方法として配当を実施する可能性はありますが、事業計画の期間においては配当の実施を予定していません。
発行者の事業において販売するサービスは、販売時の景気動向、市場の需給状況により予定販売単価及び想定販売数量を大幅に下回る可能性があります。
著しい売上高の下落、予想外のコストの発生、現時点で想定していない事態の発生などの事象により、資金繰りが悪化するリスクがあります。
発行者は、事業を実施するにあたり関連する許認可が必要となる可能性があります。発行者が既に必要な許認可を得ている場合であっても、法令に定める基準に違反した等の理由により、あるいは規制の強化や変更等がなされたことにより、その後に係る許認可が取り消され、事業に重大な支障が生じるリスクがあります。
発行者の事業は、代表取締役の橋本正氏の働きに依存している面があり、同氏に不測の事態が発生した場合、発行者の事業展開に支障が生じる可能性があります。
ファンディング・プロジェクトが成立しても、払込金額及び振込手数料が一部のお客様より払い込まれないことにより、発行者が当初目的としていた業務のための資金調達ができず、発行者の財務状況・経営成績に悪影響を及ぼす可能性があります。
発行者から当社に対しては、審査料10万円(税込:11万円)が支払われるほか、今回の株式投資型クラウドファンディングが成立した場合、募集取扱業務に対する手数料として、株式の発行価格の総額の20%(税込:22%)相当額(2度目以降の場合は総額の15%(税込:16.5%)相当額)が支払われます。また、企業情報開示のためのシステム利用や当社サポート機能の提供に対するシステム及びサポート機能利用料として、毎月5万円(年間60万円)(税込:5万5千円(年間66万円))と決算期に5万円(税込:5万5千円)を発行者から当社が申し受けます。なお、当社が定める期限までに月次、四半期及び決算に関する企業情報等が開示された場合、システム及びサポート機能利用料は免除されます。


