【最先端のがん再生医療】世界が注目するゲノム情報を活用した創薬技術で個別化医療の実現を目指す



※同社のプロジェクトのお申込みにあたっては、「ロックアップに関する確約書」のご提出が必要となります。
プロジェクト概要
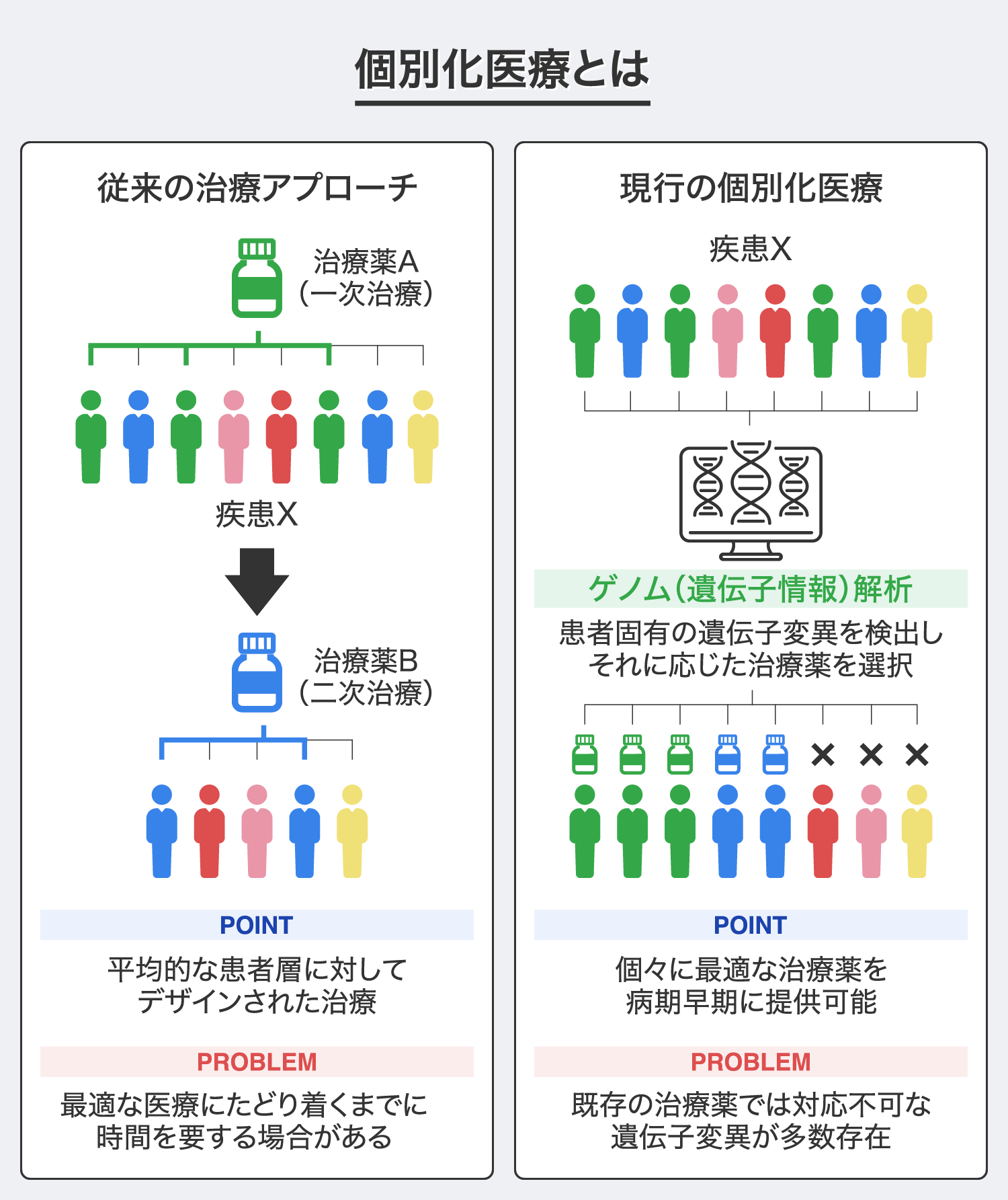
弊社は、再生医療技術を用いた細胞製剤や遺伝子治療薬を開発し、一人ひとりに最適な治療を早期に提供する個別化医療の実現を目指しています。

現行の標準的な治療は、同じ病名の患者には同じ治療薬を原則提供し、有効性が確認できなければ別の治療薬を提供するという画一的な治療アプローチです。これに対して、個別化医療(オーダーメイド医療)は、患者一人ひとりのゲノム情報(遺伝子の集合体)に基づき、例え同じ病名であっても個々の患者に適した治療薬をそれぞれ提供するという新しい治療アプローチで、患者にとって最適治療を早期に受けられるというメリットがあると考えています。
そして現在、個別化医療の導入が最も期待されている疾患領域は「がん」であり、がん患者のゲノム情報を活用した「がん個別化医療」の臨床実用化に注目が集まっています※1。しかし、がん患者一人ひとりに適した治療薬を提供しようとなると多種多様な治療薬が必要となりますが、最適な治療薬が見つかるケースはほとんど無い※2のが現状で、個別化医療に対応可能な治療薬の開発が急務だと考えています。
1 出典:特定非営利活動法人 日本医療政策機構(HGPI)『【政策提言】「がん個別化医療」の特質を踏まえた医療体制等の整備に向けて(2022年9月20日)』
2 出典:国立研究開発法人 国立がん研究センター 中央病院『よくある質問|遺伝子検査について』
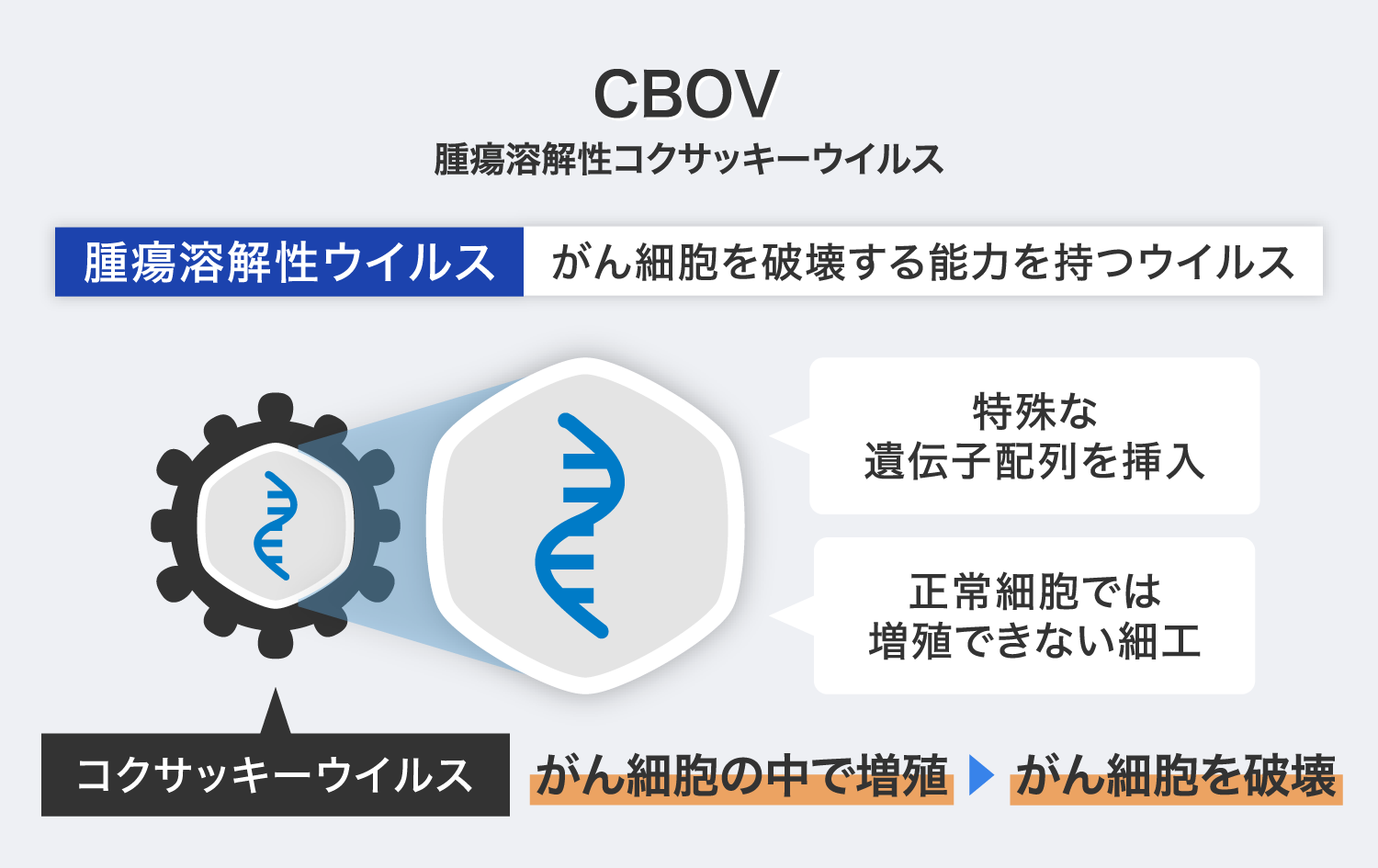
そこで、弊社では患者のゲノム情報を活用できる再生医療技術を用いた治療薬の開発を行っています。現在、がんに対する個別化治療薬として「個別化抗原提示細胞ワクチン(以下、PAPCワクチン)」と「腫瘍溶解性コクサッキーウイルス(以下、CBOV)」の2品目を開発しています。

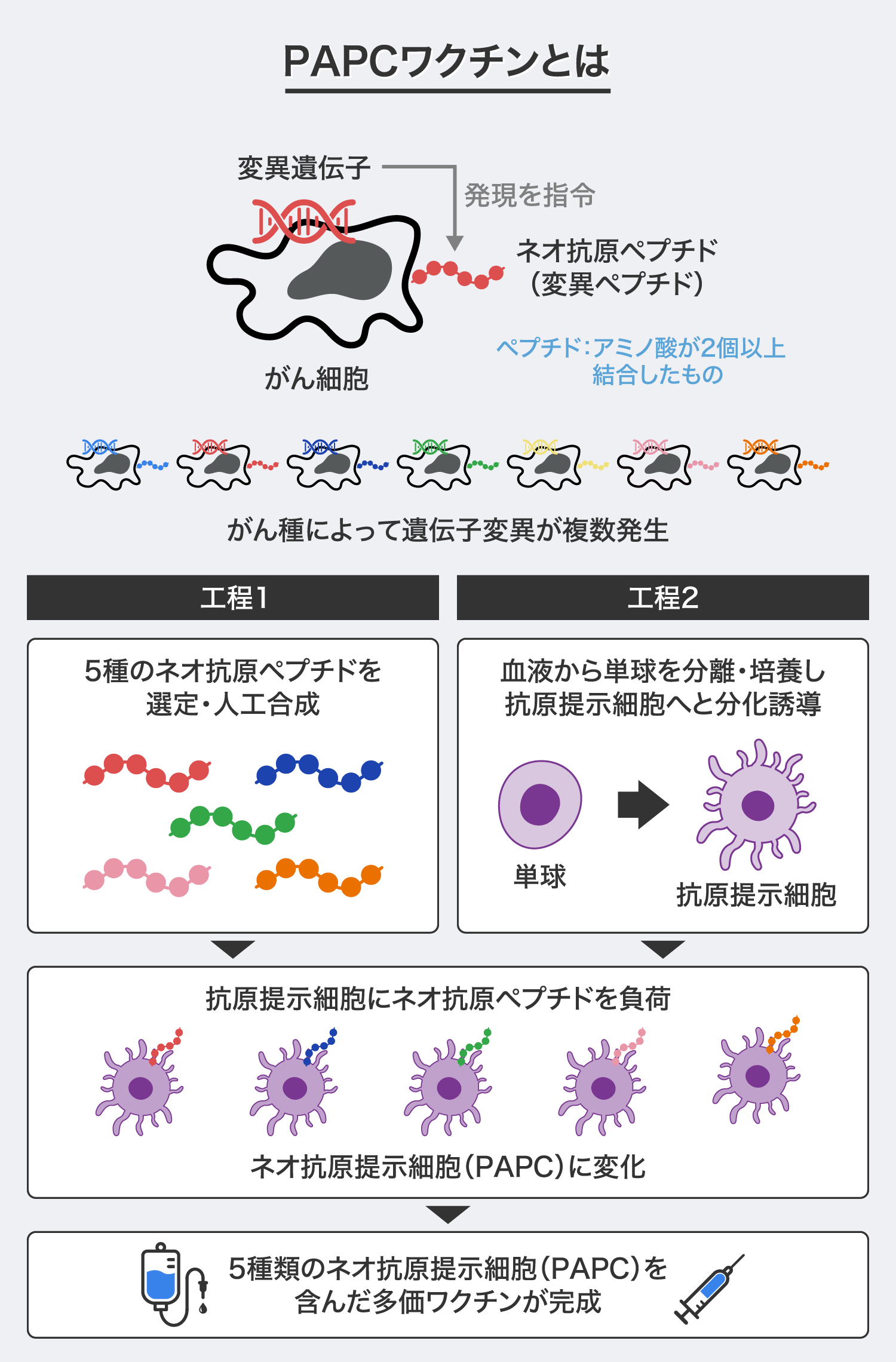
「PAPCワクチン」は、がん患者のがん細胞に発現するネオ抗原ペプチドと呼ばれる遺伝子変異に由来する変異ペプチドを、同じ患者から得られた抗原提示細胞に負荷し、再びそれを患者の体内に戻すがん免疫細胞療法です。
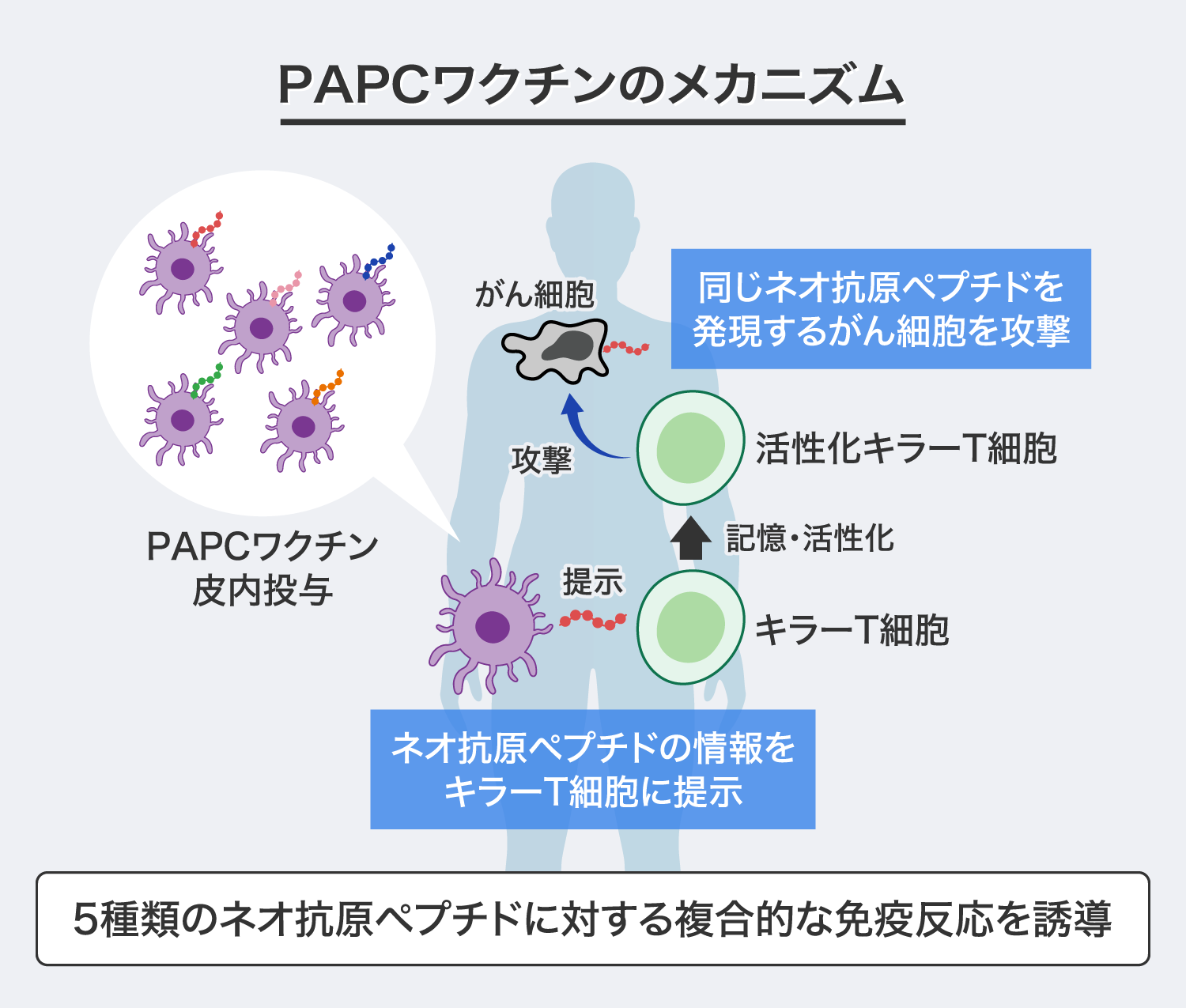
「PAPCワクチン」の治療メカニズムは、体内でがん細胞を攻撃するキラーT細胞に、ネオ抗原ペプチドの情報を記憶・活性化させ、キラーT細胞によるがん細胞の攻撃を誘導するというものです。また、「PAPCワクチン」には5種類の異なるネオ抗原ペプチドを使用しているため、体内では5種類のキラーT細胞を活性化することで複合的な免疫反応を誘導することが可能だと考えています。
▲クリックすると、動画をご覧いただけます。(FUNDINNOが作成した動画ではありません)
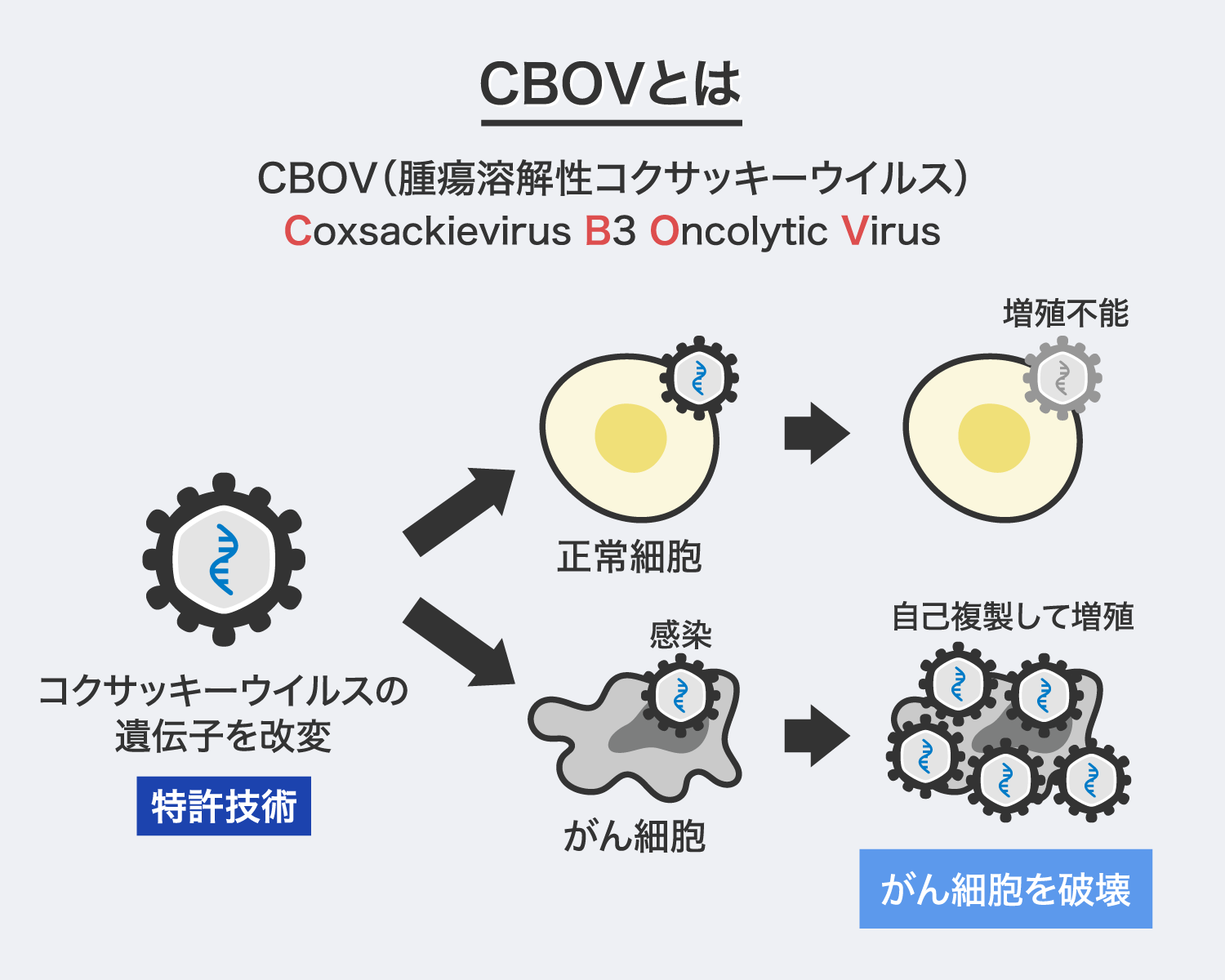
「CBOV」は、人間の腸などに存在するエンテロウイルスに属する「コクサッキーウイルスB群3型」の遺伝子を改変した腫瘍溶解性ウイルスです。腫瘍溶解性ウイルスとは、がん細胞に感染・増殖して細胞を破壊する能力(殺細胞効果)を有するウイルスの総称で、弊社では約40種類のエンテロウイルスをスクリーニングし、コクサッキーウイルスB群3型の強い殺細胞効果を発見し開発を進めてきました。この過程で改良を重ね、ウイルスが正常細胞に感染しても増殖できないように遺伝子改変したものが「CBOV」です。
「PAPCワクチン」の製法開発は既に終了し、現在、治験に向けたデータ収集と規制当局との面談を実施しています。「CBOV」については、ウイルス製造と品質管理に係る基盤技術は確立しており、今後、ラージスケールでのウイルス製造の製法開発と動物での安全性データの取得を目指します。
弊社は、個別化医療の実現によって、従来の画一的な治療法では治療困難な病気に対し、再生医療技術を用いた新たな治療の選択肢を提供することで、社会に貢献したいと考えています。そして、将来的には株式上場(IPO)を果たし、さらなる飛躍を目指します。
▲クリックすると、動画をご覧いただけます。
解決したい課題
最適な治療にたどり着くまでの長い道のりがもたらすデメリット
現在、多くの臨床現場では、同じ病名の患者には同じ治療薬を原則提供し、有効性が確認できなければ別の治療薬を提供するという画一的かつ試行錯誤的な治療方法がとられており、この方法は平均的な患者層に対して一定の有効性を発揮できるというメリットがあると考えています。
しかしその一方で、最適な治療薬にたどり着くまで長期間にわたり複数の治療薬を服用するケースも珍しくありません。例えば「がん」のように人の生死に直結する病気の場合、より早い段階での最適治療薬の提供が重要です。
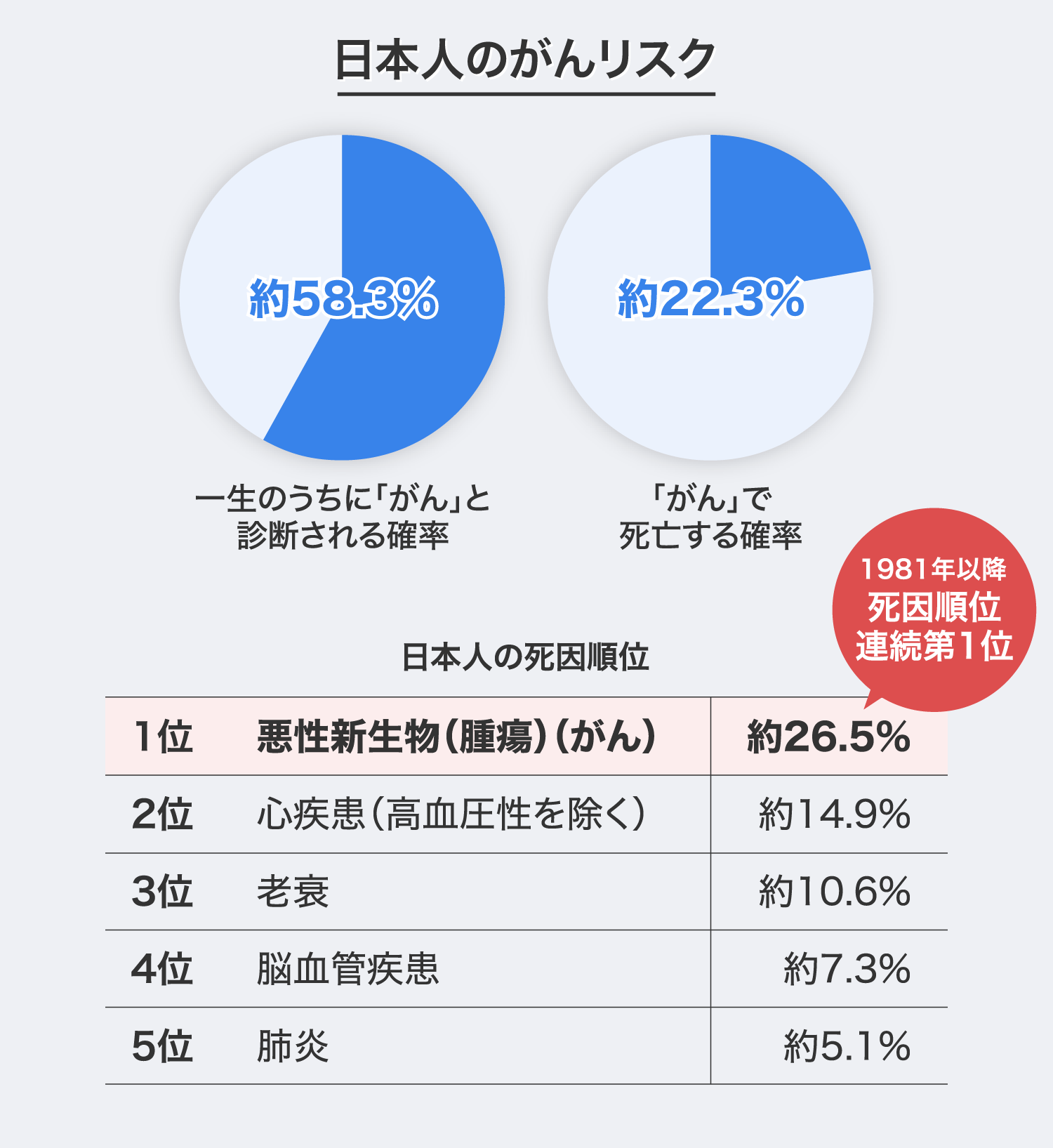
日本人の場合、一生のうちに「がん」と診断される確率は約58.3%、「がん」で死亡する確率は約22.3%とされ※1、「がん」は40年以上連続して死因の第1位となっています※2。
1 出典:国立研究開発法人 国立がん研究センター『最新がん統計』より、男女合計の平均値を算出
2 出典:厚生労働省『令和3年(2021) 人口動態統計月報年計(概数)の概況』
そして、病気の特性上、高齢になるに従いこれらのリスクも高まるため、このままの治療方法を続けていては超高齢化の加速に伴いがん死亡率はさらに増加することが予測されます。このため、既に国民病となった「がん」に対する新しい治療アプローチや治療薬の開発が活発化して※います。
出典:医薬産業政策研究所『日本で承認された新医薬品とその審査期間|図8 抗悪性腫瘍薬承認品目数の年次推移』
「がん」という病気は正常細胞の遺伝子が変異することで生じることが分かっています。また、遺伝子変異のパターンが一人ひとり全く異なるため、遺伝的多様性に富んだ病気であり、画一的な治療薬の提供では治療困難な病気だと、がん研究の世界では考えられています。
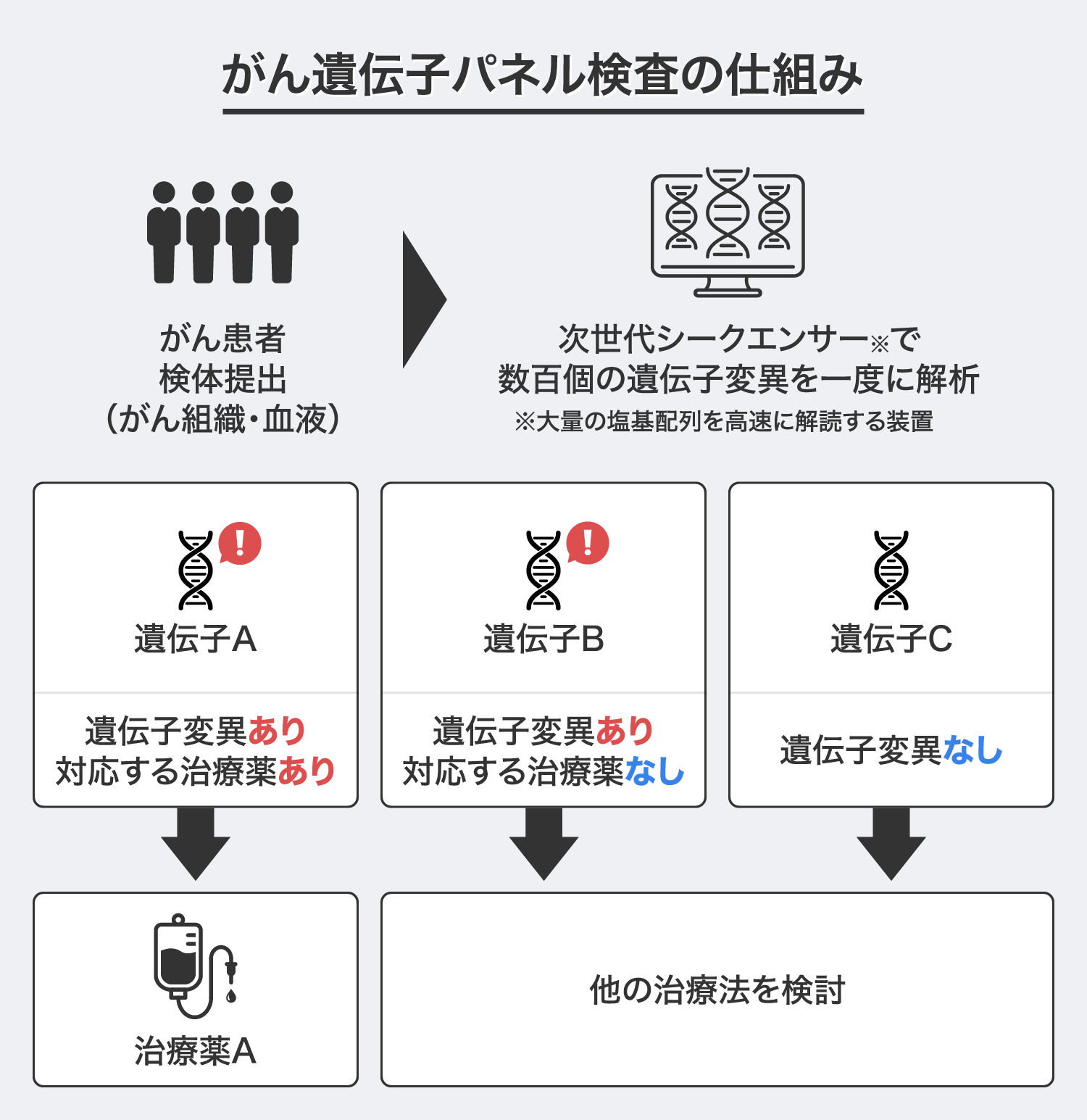
このような「がん」の特性を踏まえ、患者一人ひとりのゲノム情報を解析し、それを治療に応用する「がん個別化医療」の取り組みが始まっています。そして、2003年のヒトゲノム計画※完了を契機としたゲノム解析技術の著しい発展により、2019年から100種類以上の遺伝子変異の有無を調べる「がん遺伝子パネル検査」が保険適用されたことで、がんゲノム情報に基づき最適な治療薬を選択する「がん個別化医療」が日本でも実用可能となりました。
ヒトゲノム計画(Human Genome Project:HGP):ヒト染色体の全塩基配列を解析・研究するプロジェクト。米国を中心に国際協力のもとで進められた。
しかし、「がん遺伝子パネル検査」を受診する患者数は年々増えているものの、治療につながる可能性のある遺伝子変異が見つかる確率は50%程度、さらにその結果に基づいて治療薬が提供された患者は全体の10~20%程度と治療実績は決して多くありません※。
出典:国立研究開発法人 国立がん研究センター 中央病院『よくある質問|遺伝子検査について』
この要因の1つが患者に提供可能な治療薬が少ないことであり、「がん個別化医療」が普及しつつある今、個々の患者のゲノム情報を活用することが可能な治療薬の開発が喫緊の課題となっています。
どの様に解決するか
個別化医療に対応可能な治療薬を開発し、早期に最適な治療を提供
個別化医療とは、患者一人ひとりのゲノム情報を解析し、その結果に基づいて最適治療の提供を行う治療アプローチですが、この実現には患者一人ひとりに対応し得る数の治療薬が必要です。
これまでは治療薬=医薬品だったため治療の選択肢に限界がありましたが、近年の再生医療技術の進歩によって細胞を主成分とした細胞製剤や遺伝子・ウイルスを主成分とした遺伝子治療薬といった新しいカテゴリーの治療薬が登場したことで、今後はより多くの治療選択肢を患者に提供することが可能になると考えています。
個別化医療の実現は、最適治療の早期提供(患者メリット)、試行錯誤的な治療選択の回避(医師メリット)、無効治療の提供を回避することによる医療費削減(社会メリット)をもたらすことが期待され、非常に社会的意義の大きい取り組みであると感じています。
弊社では、個別化医療の実現に向けた第一弾として、独自の再生医療技術を活かした「PAPCワクチン」と「CBOV」によって、従来の治療薬では治療困難ながん患者に対する新たな治療選択肢の提供を目指しています。
「PAPCワクチン」の実用化と保険適用による標準治療化
1つ目のパイプライン(医薬品候補化合物)である「PAPCワクチン」は、弊社独自のがん免疫細胞療法で、食道がん等の遺伝子の変異割合が高いがん種を対象に開発を進めています。
「PAPCワクチン」は、ネオ抗原解析と細胞製造の2つの工程を経て完成します。まず、がん患者のがん細胞の中で発生する変異遺伝子とこれに由来する変異ペプチド(ネオ抗原ペプチド)の情報を網羅的に収集する工程がネオ抗原解析です。この解析データに基づき独自の選定方法に従って高い治療効果が期待できる5種類のネオ抗原ペプチドを選定・人工合成します。
続いて、同じがん患者の血液から単球と呼ばれる細胞を取り出し、独自の培養技術を用いて抗原提示細胞へと変化させる細胞製造を行います。この抗原提示細胞に5種類のネオ抗原ペプチドを負荷した製品が「PAPCワクチン」です。
これを患者に投与すると5種類のキラーT細胞がネオ抗原ペプチドの情報を記憶し、記憶したネオ抗原ペプチドと同じものを出すがん細胞を見つけると攻撃するというのが「PAPCワクチン」の治療メカニズムです。5種類のネオ抗原ペプチドによって、5種類のキラーT細胞を活性化させ、複合的な免疫反応によるがん細胞の攻撃を誘導します。
現在、大学との共同研究において、実際の食道がん患者における in vitro 薬効試験※を実施し、免疫反応の誘導を確認しております。今後は、治験において「PAPCワクチン」の安全性・有効性を検証し、薬事承認を目指します。
In vitro 薬効試験:がん患者の生体内を模した環境の中で有効性を評価する試験
ウイルスの増殖力を利用した、腫瘍溶解性ウイルス薬「CBOV」を開発
2つ目のパイプラインとして、腫瘍溶解性ウイルスである「CBOV」の開発を行っています。
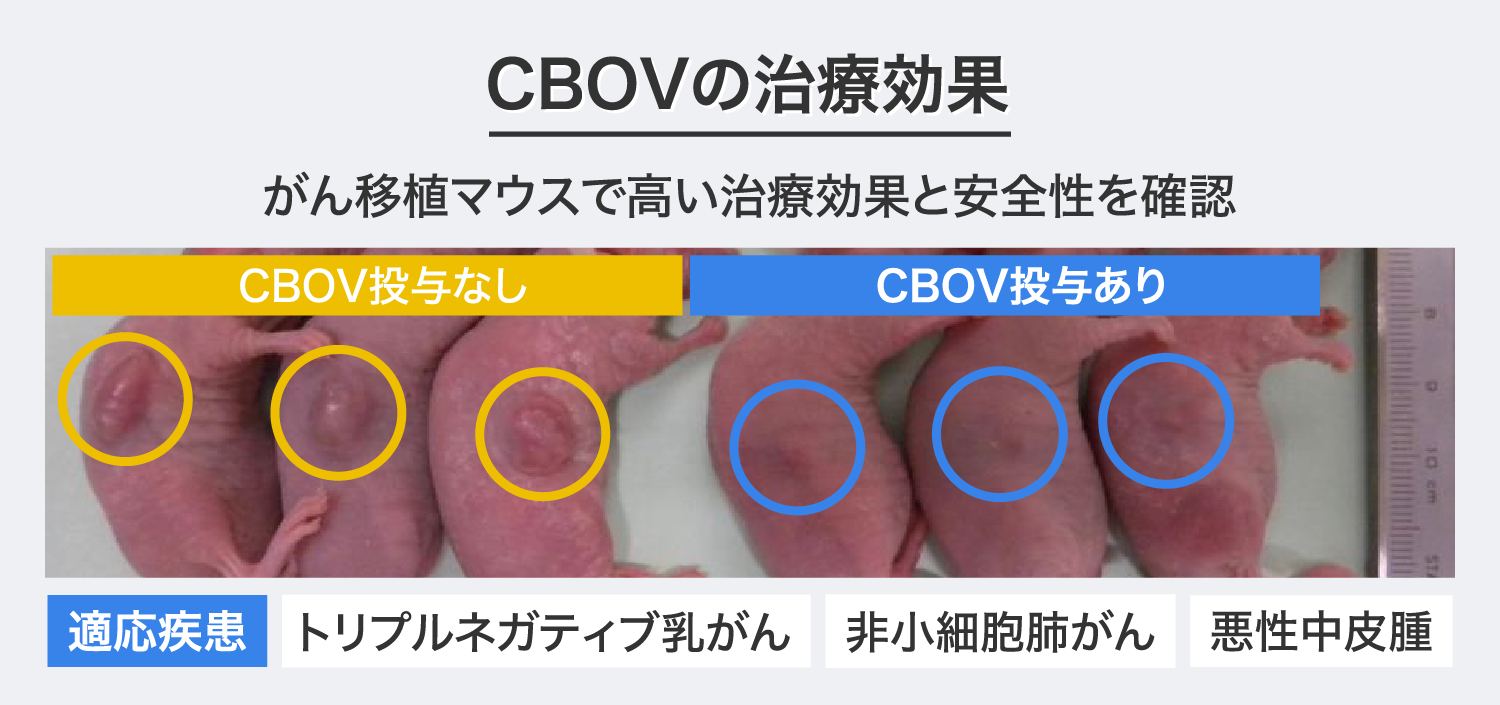
「CBOV」は、人間の腸などに存在する「コクサッキーウイルス」をがん細胞の中だけで増殖するように遺伝子改変したウイルス製剤で、正常な細胞では増殖を制限する細工を施しており、動物実験での有効性・安全性を確認しています。
類似品として、「単純ヘルペスウイルス」を使った腫瘍溶解性ウイルスが国内販売されています。これは、がん細胞にウイルスを直接投与する局所的な治療には効果的ですが、身体中にがんが転移した患者に対して必ずしも有効とは言えません。
弊社の「CBOV」は、静脈からの全身投与でも、がん細胞に直接投与する局所投与でも、同等の殺細胞効果があることを動物実験で確認しており、がんの全身転移が起きている患者に対して、有効な治療になると考えています。
ビジネス化の方法
「PAPCワクチン」の自社販売によって収益化を目指す
「PAPCワクチン」の根幹技術であるネオ抗原ペプチドの選定方法と抗原提示細胞の加工技術は、特許を取得せずに弊社独自のノウハウとして秘匿し、自社販売による収益の最大化と適応疾患拡大によって事業成長を目指します。
「PAPCワクチン」が最初に対象とする疾患として食道がんを考えています。対象疾患の選定基準は、遺伝子変異の割合が中~高程度のがん種であること、年間罹患者数が数千人を超えること、競合する医薬品が少ないことを条件としました。
食道がんの年間罹患者数は最新(2019年)の統計で26,382例※とされていますが、「PAPCワクチン」等の薬物療法の対象となるステージⅣや再発患者の数は約9,000人と推計しています。また、食道がんは消化器がんの中でも比較的予後が悪いがん種で、今後も増加傾向にあると考えています。
出典:国立研究開発法人 国立がん研究センターがん情報サービス『がん統計|全国がん登録』(2019年)
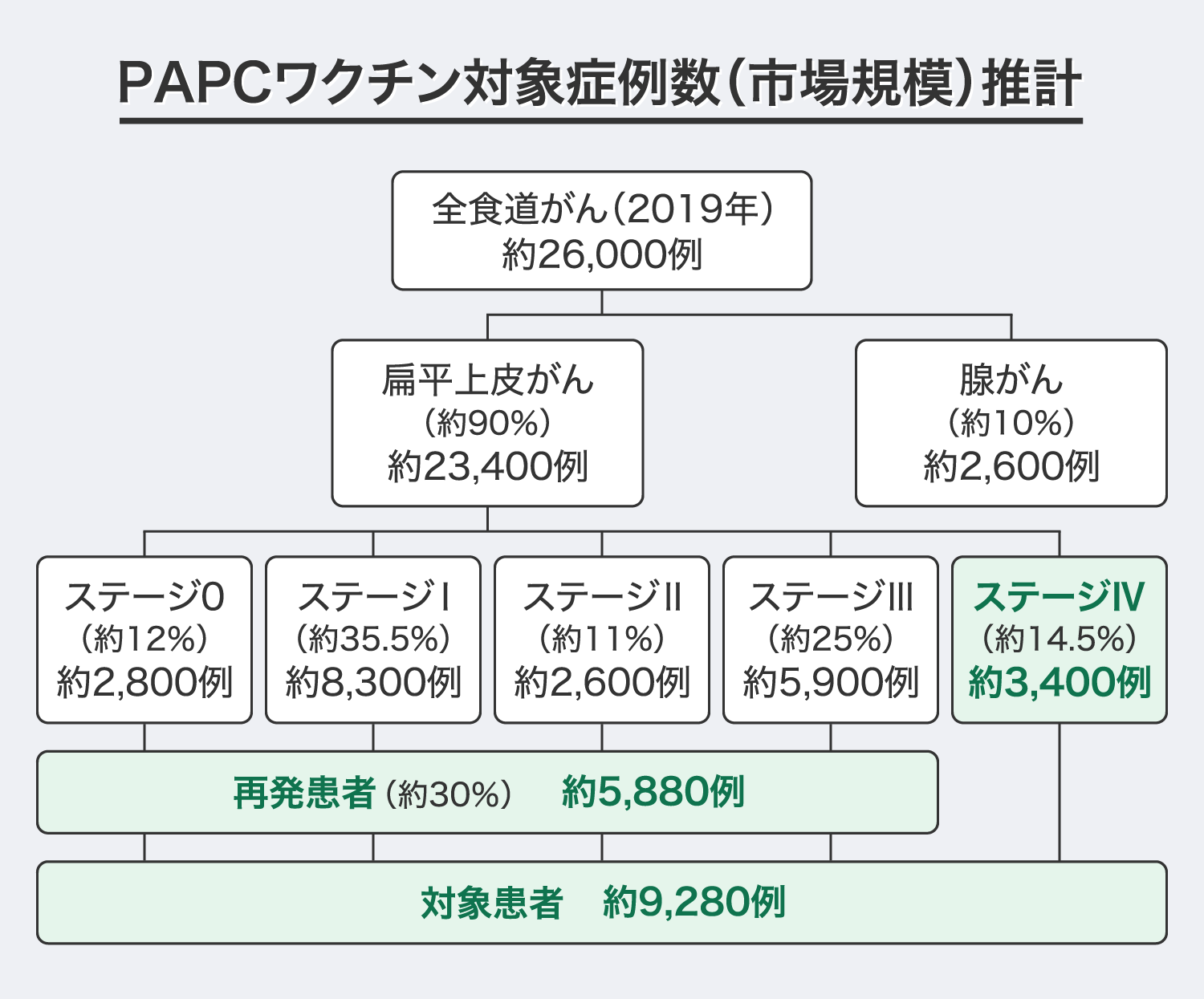
出典(扁平上皮がん/腺がんの割合、症例数):国立研究開発法人 国立がん研究センター『食道がんについて|組織型分類(がんの組織の状態による分類)』をもとに算出
出典(ステージ別症例数):公益財団法人がん研究振興財団『がんの統計 '16|院内がん登録からみたがん診療連携拠点病院における臨床病期の分布』をもとに算出
出典(再発患者数):国家公務員共済組合連合会 虎の門病院『食道がん治療センター|食道がんの再発・転移と生存率』をもとに割合を30%と仮定して算出
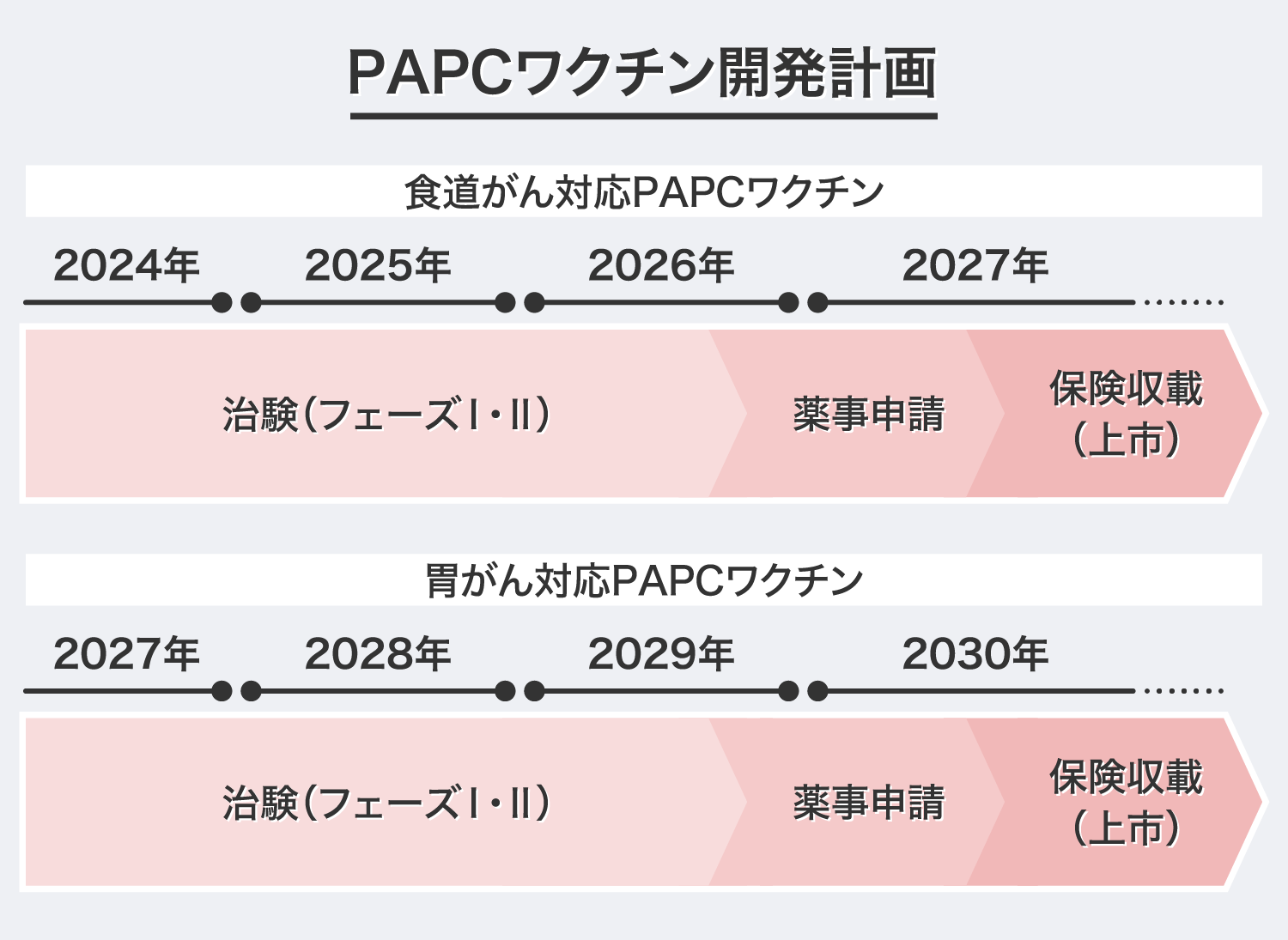
現在、2024年の治験開始を目指して食道がん患者に対する「PAPCワクチン」の開発を進めております。2年間の治験期間を経た後、条件及び期限付き承認制度※を活用して2027年の薬事承認(製品化)を果たしたいと考えています。その後、適応疾患を胃がんに拡大し、2027年から治験を開始、2030年の薬事承認を目指します。
条件及び期限付き承認制度:疾患に対する有用な医薬品について、一定の条件を満たすことを条件に、臨床試験の一部を省略し、早期の実用化を推進する制度。
保険収載:薬機法に基づく承認を受けた医薬品等が、保険診療に用いられる医療用医薬品等として官報で告示される薬価基準に掲載されること
食道がん患者を対象とした「PAPCワクチン」の治験は、標準的治療に不応・不耐の患者に対して行う予定です。現行の食道がんの薬物療法には3種類の標準治療薬が存在するため、薬事承認後、「PAPCワクチン」は4種類目の治療薬として位置づけられると考えています。
将来的に「PAPCワクチン」を一次治療薬の選択肢に引き上げるために、既存治療薬との比較試験を行う他、学会発表や各種メディアを通じた発信によって「PAPCワクチン」及び個別化医療の考え方を社会に浸透させたいと考えています。
▲クリックすると、動画をご覧いただけます。(FUNDINNOが作成した動画ではありません)
なお、「PAPCワクチン」の国内販売にあたっては、人口密集地である南関東を重点販売地域とし、2年ほどかけて地方の主要都市に販路を拡大する計画です。弊社の試算では、ピーク時の対象患者数(ステージⅣ+再発患者数)は年間約3,000人になると見込んでいます。
「PAPCワクチン」根幹技術の秘匿化で競合優位性を構築
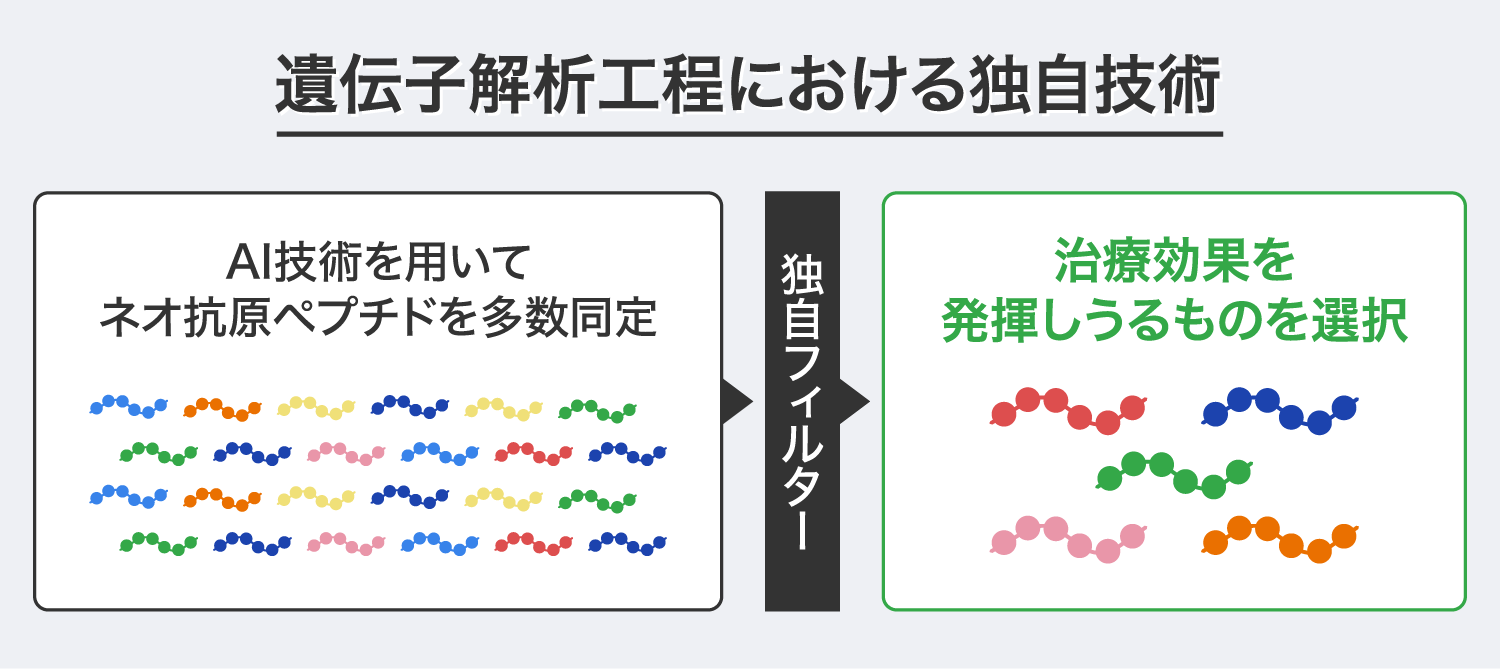
「PAPCワクチン」は、遺伝子解析と細胞製造の2工程を経て完成します。前者は、がん患者の正常細胞とがん細胞を取り出し、AI技術を用いたネオ抗原解析によって、がん細胞の遺伝子変異によって発現する「ネオ抗原ペプチド」を多数同定します。このネオ抗原解析によるネオ抗原ペプチドの同定はこれまでの技術で対応可能でしたが、多数のネオ抗原ペプチドの中から治療効果が期待されるものを選択できるかが課題となっています。
弊社ではこの課題を解決するために、ネオ抗原ペプチドの選択時に複数の独自フィルターを設けることで治療効果に繋がらないものを除外し、治療効果を発揮しうるものを合理的に選定する手法を見出し、これが「PAPCワクチン」の根幹技術を支えるノウハウの1つとなっています。
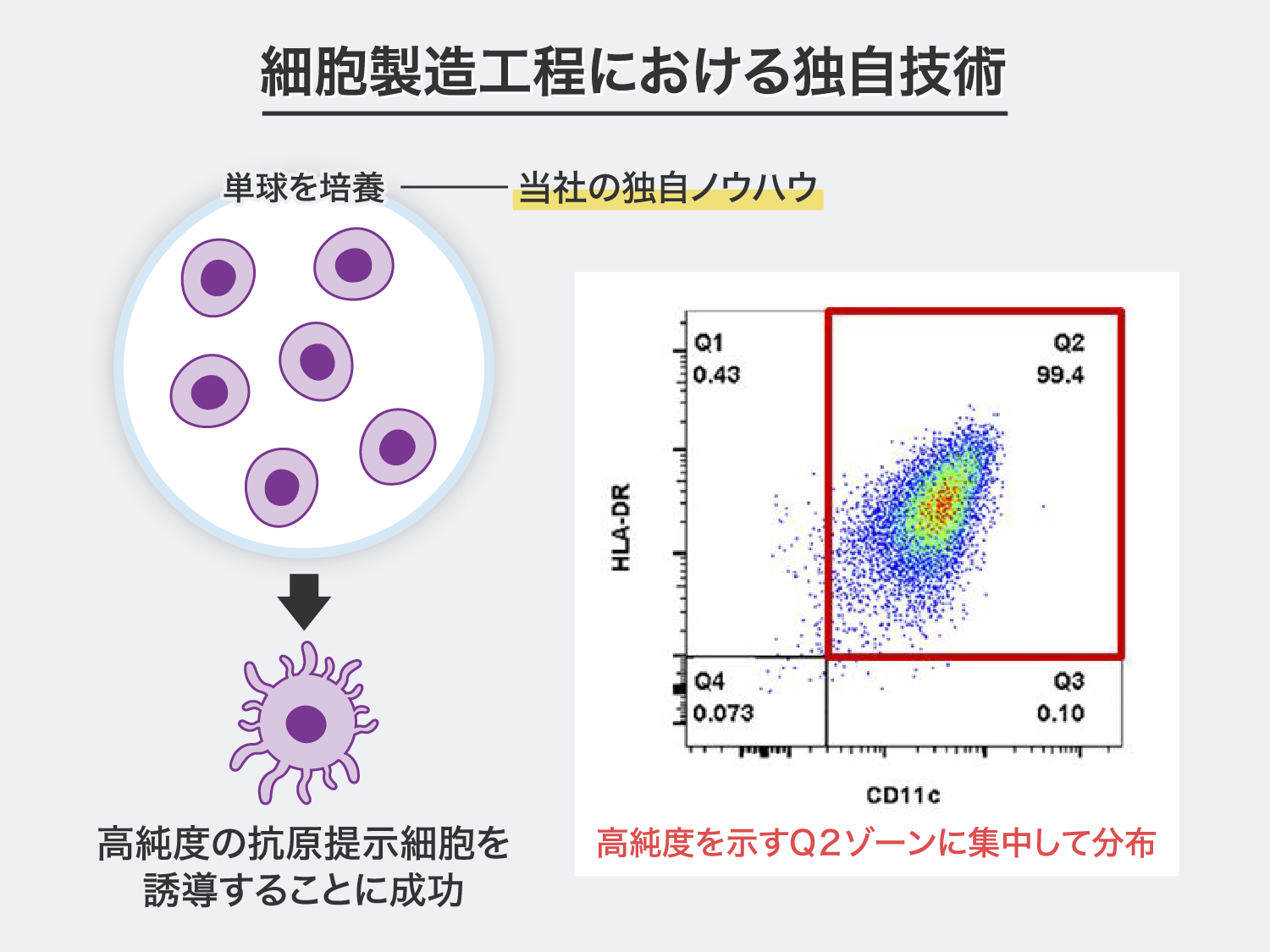
また、細胞製造工程において、弊社では独自ノウハウを用いることにより、高純度の抗原提示細胞を単球(PAPCワクチンの原料細胞であり白血球の一種)から誘導することに成功しています。「PAPCワクチン」の主成分である抗原提示細胞の純度が高くなるほど治療効果も高まるため、この独自製法が「PAPCワクチン」の根幹技術を支える2つ目のノウハウです。
ウイルス受容体を発現する固形がんを対象に「CBOV」を実用化
「CBOV」は、「コクサッキーウイルスB群3型」の遺伝子を改変し、正常細胞に対する細胞毒性を減弱させた安全性の高い腫瘍溶解性ウイルスです。コクサッキーウイルスB群3型を動物に投与するとがん細胞は小さく退縮する一方で、いくつかの正常細胞でもウイルスが増殖し炎症反応等の副作用を示すことが分かっています。弊社では、この副作用を解決するためにウイルスゲノムに「RNA干渉※」が誘導される短い塩基配列を挿入した「CBOV」を開発しました。この遺伝子改変技術により、ウイルスが正常細胞に感染しても増殖しないようにRNA干渉で制御され、副作用をほとんど示すこと無くがん細胞のみを退縮又は消失させることに成功しました。
RNA干渉:身体の細胞に元々備わっている遺伝子発現の制御メカニズムで、この発見者は2006年にノーベル生理学・医学賞を受賞している。
「CBOV」の適応疾患は、動物実験で治療効果と安全性が確認された、トリプルネガティブ乳がん※1・非小細胞肺がん※2・悪性中皮腫※3を想定しており、対象患者はステージⅣ及び再発患者を想定しています。
1 トリプルネガティブ乳がん:治療標的となる3つの受容体が欠如した乳がんの種類。
2 非小細胞肺がん:肺がんは治療の効きやすさや進行速度の違いから小細胞肺がんと非小細胞肺がんの2つに分類される。非小細胞肺がんの種類には腺がん・扁平上皮がん・大細胞がんなどがある。
3 悪性中皮腫:胸膜や腹膜の表面を覆う中皮細胞から発生する腫瘍。
この技術は、発明者の教授が所属する大学と弊社が共同で特許権を有しており、日本・アメリカ・中国・イタリア・ドイツ・フランス・イギリス・オランダの計8ヵ国で特許を出願しています。
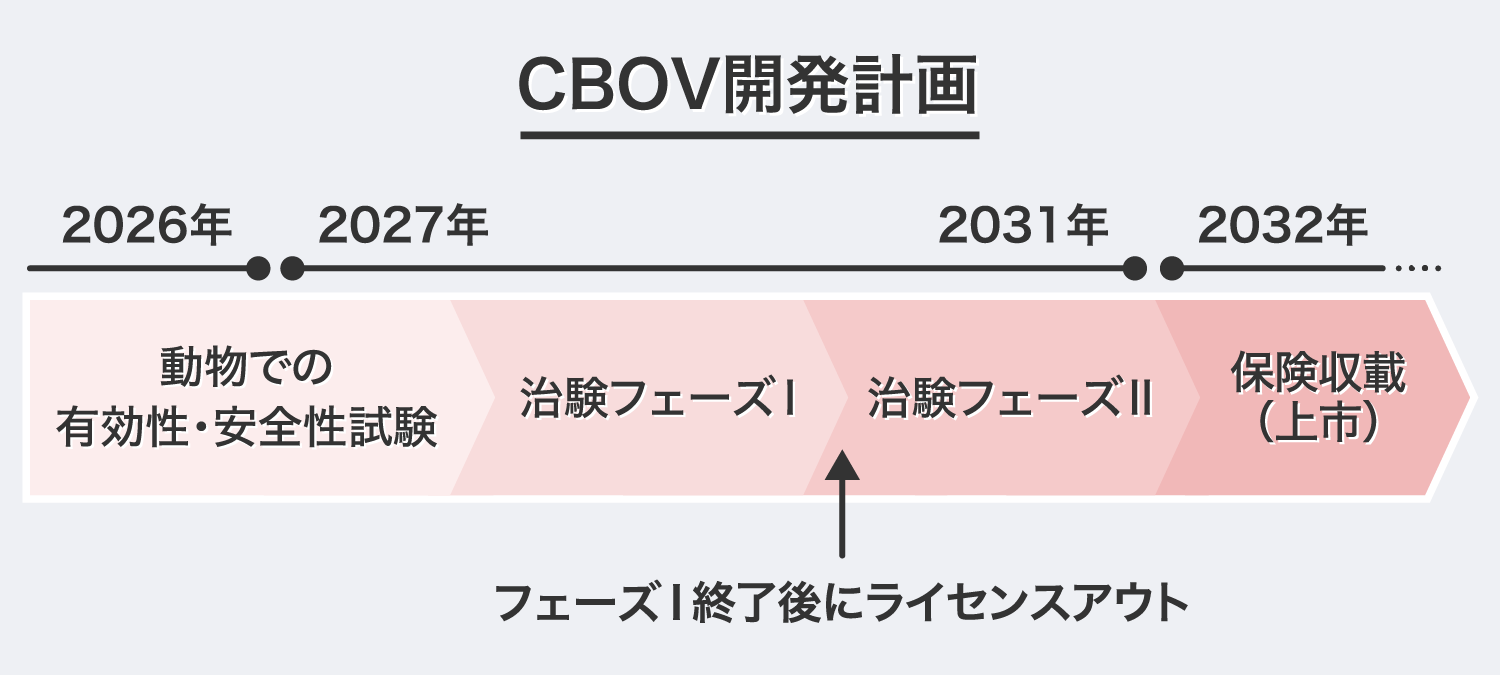
すでにウイルスの製造・品質管理に係る基盤技術は確立しており、今後、商用製造に向けたラージスケールでのウイルス製造の製法開発と動物試験で安全性等を確認した後、治験を開始する予定です。その後、国内外の製薬会社向けにライセンスアウトを行い、ロイヤリティ収入による収益化を目指します。
今後の成長ストーリー
食道がんでの「PAPCワクチン」保険収載を果たし、適応疾患拡大を目指す
現在、「PAPCワクチン」は保険収載を目指し、治験に向けた準備を進めています。治験開始は2024年を予定しており、条件及び期限付き承認制度を活用して2027年の薬事承認を目指しています。食道がんに対する「PAPCワクチン」の薬事承認と同時に、胃がんに対する「PAPCワクチン」の治験を開始し、2030年の薬事承認を目指します。
「PAPCワクチン」で使用するネオ抗原ペプチドは、がん細胞の遺伝子変異によって発現します。よって、食道がん、胃がんに続く対象疾患は、遺伝子変異量が多いことに加えて標準的な薬物療法が効きにくいがん種が該当すると考えています。
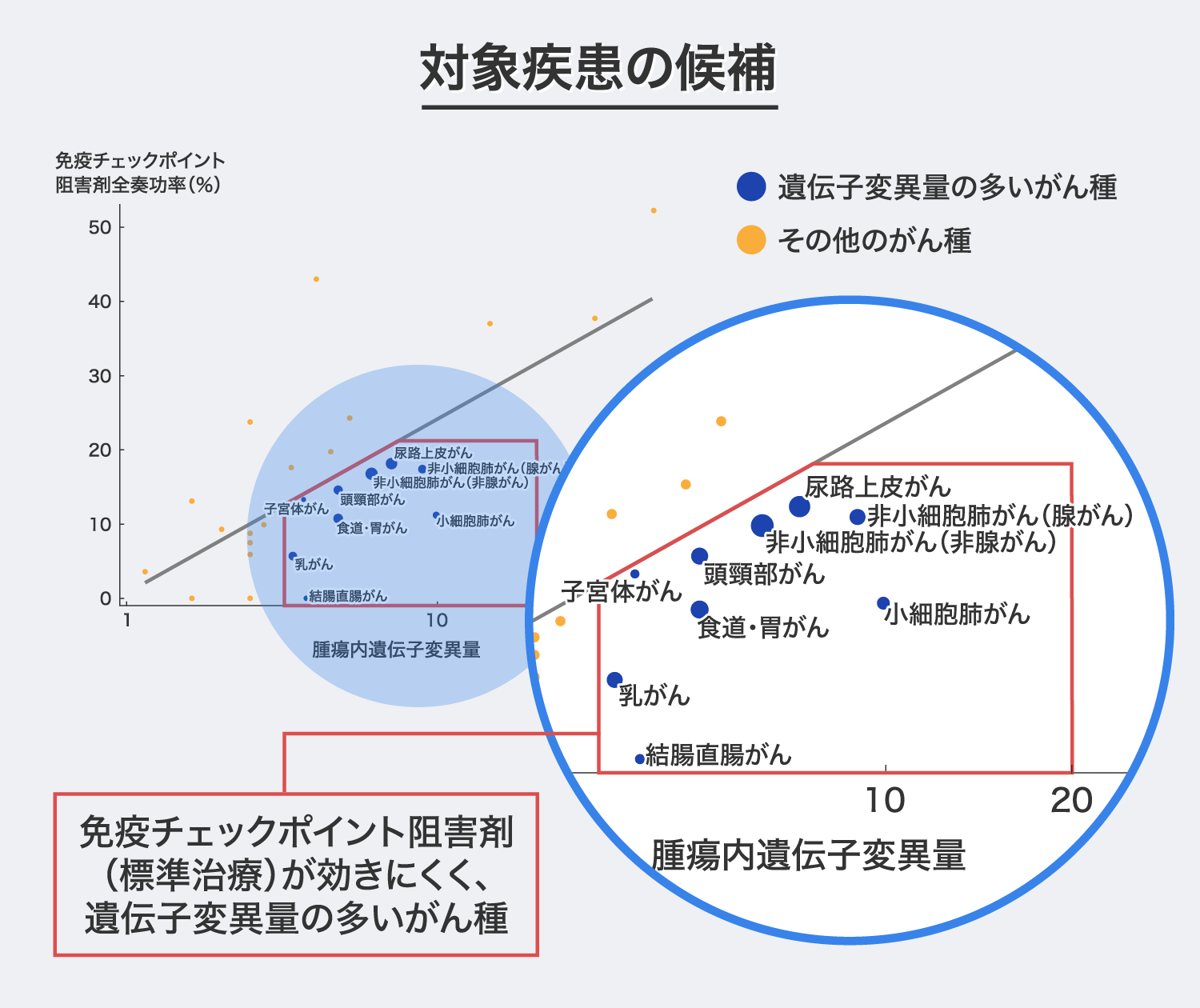
出典:Tumor Mutational Burden and Response Rate to PD-1 inhibition ( N Engl J Med. 2017) Figure 1.. Correlation between Tumor Mutational Burden and Objective Response Rate with Anti–PD-1 or Anti-PD–L1 Therapy in 27 Tumor Types.をもとに画像を作成
専用自動培養装置の開発で「PAPCワクチン」の大量生産体制を構築
現在、「PAPCワクチン」は製造スタッフの手によって製造されていますが、より多くの患者に提供するにはこの製造方法では限界があります。そこで現在、弊社では自動培養装置の開発を進めています。基本設計は終了し、今後はプロトタイプの開発に着手し、2029年の実用化を目指しています。「PAPCワクチン」を自動培養装置で製造することで、生産効率が向上し、製造品質のバラつきを小さくすることが可能になると考えています。
また、「PAPCワクチン」の製造所については、東日本と西日本に1か所ずつ拠点を置くことを目指しています。

「CBOV」特許出願国でのグローバル展開を目指す
「CBOV」の製造においては、大量かつ高純度のウイルスを得るために、イオン交換クロマトグラフィー(試料中の荷電状態の差を利用した成分の分離法)による閉鎖系環境(製品や原材料が製造環境に曝露しないように対策された環境)での精製方法を確立しました。この製法で得られた製剤中にはウイルス以外の不純物が含まれていないことを確認しており、今後は実製造と同じ機器を購入し、商用製造に向けた製法開発を進める計画です。
2026年頃までに、製法開発と動物での有効性・安全性を確認し、治験を開始する計画です。治験(フェーズⅠ)でヒト安全性を確認した後、ライセンスアウトに向け製薬会社へのアプローチを開始したいと考えています。ライセンスアウトまでの期間は、製薬会社からの契約一時金及びマイルストーン収入(新薬候補物質の開発、承認等の進捗に伴って発生する、新規化合物発明企業への支払金)を見込んでおり、2029年頃を目処に特許出願国(日本・アメリカ・中国・イタリア・ドイツ・フランス・イギリス・オランダ)の製薬会社を対象にライセンスアウトを目指しています。
マイルストーン:将来的なEXITはIPOを想定
下の表は現時点において今後の経営が事業計画通りに進展した場合のスケジュールです。そのため、今回の資金調達の成否、調達金額によって、スケジュールは変更となる場合がございますので、予めご了承ください。また、売上高は事業計画を前提としており、発行者の予想であるため、将来の株価及びIPO等を保証するものではありません。
発行者は、現在TOKYO PRO Marketへの上場と、その後の東証グロース市場を含めた一般市場上場を視野に入れております。
治験開始時に必要となる非臨床安全性及び品質に係るデータを取得し、規制当局との治験に向けた協議を行う予定です。
治験実施機関の候補は現在5施設をピックアップしており、その中から1~2施設と契約締結し、治験開始を計画しています。フェーズⅠでは、食道がん患者3~6名を対象に「PAPCワクチン」の安全性及び忍容性を評価し臨床用量の決定を、フェーズⅡでは食道がん患者6~9名を対象に有効性(免疫学的効果及び抗腫瘍効果)の検討を行う予定です。また、治験開始に伴い、製造及び品質管理部門の人員拡充を計画しています。
「CBOV」は商用製造に向けたスケールアップ製造に着手し、開発期間は約3年間を想定しています。
治験終了後、製造販売業許可の申請と薬事申請を行う計画です。この薬事申請は、条件及び期限付き承認制度と呼ばれ主に治験における安全性と有効性に係るデータを申請資料として提出することになります。
IPOに向けた準備を行いつつ、「PAPCワクチン」の薬事承認後、治験実施医療機関を含む関東圏内の数ヶ所の医療機関と提携し、販売初年度は年間168人への提供を計画しています。また、販売開始後は胃がんへの適応拡大を目指した治験を開始する予定です。
「CBOV」の治験における対象疾患は、トリプルネガティブ乳がん・非小細胞肺がん・悪性中皮腫のいずれかを想定しています(フェーズⅠ/Ⅱ)。
「PAPCワクチン」の製造販売2年目は、年間336人への提供を目指します。現在、全国の医療機関の中で食道がん患者を多く抱える病院をピックアップしていますが、「PAPCワクチン」を全国の医療機関で提供できるよう学会やセミナー等を通じてこの治療法を広めていきたいと思います。
「▶︎ボタン」をクリックすると各年度目標の詳細をご確認いただけます。
また、上記のサービス追加は、今回の資金調達に伴って行われるものではなく、今後、新たな資金調達を行うことによる追加を計画しているものです。なお、新たな資金調達の方法は現時点において未定です。
KPI:2027年度に168人分のPAPCワクチン製造を目指す
下記のKPIの推移については、事業計画書(売上高等推移予想)の内容を反映しております。なお、KPIの推移については、発行者の予測であり、必ずしも保証されるものではありません。事業計画書につきましては契約締結前交付書面の別紙1-1・別紙1-2をご確認ください。
チーム/創業経緯/株主構成など
バイオ、金融に強いメンバーが集結
弊社代表の原は、これまでがん免疫療法の基礎研究~臨床応用を経験し、再生医療技術に関する幅広い知識を有しています。また、原のアイデアを実現する研究員・技術顧問に加えて、金融やバイオに強いメンバーが参画しています。
チーム

長野県伊那市出身
鈴鹿医療科学大学鍼灸学部卒、三重大学大学院生命医科学専攻 博士(医学)修了
| 2014年 | バイオコモ株式会社に入社。ウイルスベクターを用いた感染症ワクチン・樹状細胞ワクチンの研究開発に携わる。 |
| 2015年 | 医療法人社団聖友会内藤メディカル・クリニックに入社。がん治療用の各種免疫細胞の製造管理に携わる。 |
| 2017年 | 新日本製薬株式会社に入社。東京大学医科学研究所において、PAPCワクチン及びCBOVの研究開発に携わる。 |
| 2020年 | 株式会社NPT 代表取締役に就任 |

| 1990年 | 監査法人トーマツ(現有限責任監査法人トーマツ)入社 |
| 2003年 | 株式会社シコー技研(現シコー株式会社)監査役 |
| 2006年 | ユビキタスAIコーポレーション株式会社 監査役 |
| 2009年 | 税理士法人E&M ファウンダー、社員 |
| 2010年 | 株式会社TNPパートナーズ株式会社 監査役 |
| 2019年 | 株式会社STG 監査役 |
| 2021年 | 株式会社NPTに参画 |

| 1980年 | 東京大学大学院理学部研究科生物化学専攻博士課程修了 博士(理学) |
| 1982年 | 米国DNAX分子細胞生物学研究所 主任研究員、研究員、ポスドク(博士研究員) |
| 1994年 | 東京大学分子細胞生物学研究所 教授 |
| 2003年 | 東京大学分子細胞生物学研究所 所長 |
| 2018年 | 東京大学定量生命科学研究所 特任教授 |
| 株式会社NPTに参画 |

| 1984年 | 野村證券株式会社入社、国内支店営業、野村國際(香港)駐在、投資情報部、企業部 |
| 2000年 | 株式会社TSUNAMIネットワークパートナーズ(現 株式会社TNPパートナーズ)設立メンバー |
| 2003年 | 株式会社TNPパートナーズ 取締役就任 |
| 2005年 | 株式会社TNPオンザロード 代表取締役社長 |
| 2007年 | ベンチャー支援組織「TSUNAMI」(現 特定非営利活動法人ベンチャー支援機構MINERVA)理事 |
| 2018年 | 株式会社NPTに参画 |
創業のきっかけ
個別化医療の実現によって、一人ひとりに適した治療を届けたい

「個別化医療」とは、ヒトのゲノム情報に基づき一人ひとりに適した治療を提供するというのが基本的な考え方で、今から30年程前からこの必要性が叫ばれていました。
そして、近年のゲノム解析技術の飛躍的な進歩に伴い、患者個人を遺伝子レベルで調べると、同じ病名であっても遺伝的には多種多様で、この多様性こそが薬の治療効果に大きく影響していることも明らかとなり、約30年の時を経て個別化治療は現在がん領域において臨床導入されました。
しかし、今のがん個別化医療が抱える課題は、せっかく原因となった遺伝子が分かってもそれに対応可能な治療薬がほとんど無いことで、一人ひとりに適した治療を提供するためには、今まで以上に数多くの治療薬をラインナップする必要があります。
このような医療問題を解決するために、弊社は個々のがん患者のがんゲノム情報に応じた新たな治療薬の開発を行い、これからの個別化医療の発展の一翼を担うべく創業しました。
メンターからの評価

私達の研究チームは九州大学生体防御医学研究所・九州大学病院勤務時代に「コクサッキーウイルスB群3型」の腫瘍溶解性を世界で初めて発見し(Cancer Res(米国癌学会雑誌)2012 May 15;72(10):2609-21)、最近安全性と有効性にさらに優れたCBOV(遺伝子改変コクサッキーウイルス)を発明しました(特許取得済)。現在、株式会社NPTの創業に携わると共に、技術顧問としてCBOV及びPAPCワクチンの開発支援を行っています。株式会社NPTが目指すがん個別化医療は、患者一人ひとりに適した治療薬を提供するという、世界的にも大変注目されている治療アプローチです。このがん個別化医療の実現によって、これまで他に治療法のなかったがん患者への強力な医療貢献ができることを心から期待しています

/ 東邦大学大学院消化器外科学講座(教授)
/ 東邦大学大学院臨床腫瘍学講座(教授)
/ 教授、医師、博士(医学)
食道がん治療の専門家として、株式会社NPTが開発するPAPCワクチンの開発支援を行っています。食道がんに対する薬物療法の治療成績は、免疫チェックポイント阻害剤の登場により飛躍的に向上しましたが、まだまだ多くの患者に対しては十分な治療成績ではありません。免疫治療は、さらなる発展が期待できる可能性があり、このような患者を一人でも多く救えるよう株式会社NPTのPAPCワクチンに期待しています。

これまで再生医療等の細胞治療プロジェクトや、現在独自で実施しているネオ抗原を用いた樹状細胞ワクチン療法の臨床研究を行っており、2021年から株式会社NPTの技術顧問としてPAPCワクチンの開発を支援しています。PAPCワクチンの治験を皮切りに、将来、個別化医療が当たり前の世の中になることを期待しています。

株式会社NPTの取り組みは今後の医療を大きく発展させる可能性を秘めたベンチャーチャレンジです。その成功のために着実に準備を重ねてきました。情報収集と実証を繰り返して、人の役に立つ、次世代の医療を築き上げるチャレンジを成功へとつなげていくためにサポートを続けます。

株式会社NPTの創業時から社外取締役としてサポートしてきました。欧米の製薬企業は個別化医療に向けた治療薬開発にいち早く活発に取り組んできておりますが、日本ではそうした開発が出遅れています。こうした中で、先行する欧米企業と競合しつつ、果敢に個別化医療に取り組んでいるのが株式会社NPTです。ご支援、よろしくお願いいたします。

ベンチャーキャピタリストとして、東京大学医科学研究所におられた創業者の谷先生とは免疫治療やウイルス治療に関してご意見を頂いてきた関係で創業当初から関わらせて頂いております。社外取締役としてベンチャー企業に欠けている「内部管理体制」について透明性の高い経営体制を作り込む事と、創薬企業として安全性を第一義とした経営ができるよう「ガバナンス」をしっかり効かせるようにしています。
プロジェクトにかける思い
個別化医療が当たり前の世の中に
▲クリックすると、動画をご覧いただけます。
個別化医療の実現には、個々の患者の遺伝的多様性に応じて数多くの治療薬をラインナップする必要があります。
その第一弾として、現在弊社では「PAPCワクチン」と「CBOV」の開発を行っています。今後は、これらパイプラインを事業化すべく、開発をさらに加速させなければなりません。今回の資金調達による資金は、「PAPCワクチン」及び「CBOV」の開発費用として使わせていただきたいと考えています。
このご支援によって、少しでも早く開発を終えて患者に届けたいと思っています。
その他
発行者情報
-
金融商品取引契約の概要
株式投資型クラウドファンディング業務として行う非上場有価証券の募集の取扱い
※ 詳しくは契約締結前交付書面「ファンディング・プロジェクトについて」をご確認ください。
※ 発行者は2022年11月20日を効力発生日として、発行可能株式総数の変更、2022年11月30日を効力発生日として、2,000分割の株式分割に伴う発行済株式総数の変更を実施しており、現時点で登記申請中です。登記完了後の発行済株式総数は4,324,000株、発行可能株式総数は10,000,000株となります。 なお、「2.募集株式の発行者の商号及び住所、資本金等」及び、上記「株式会社NPTに投資するに当たってのリスク」の「12.新株予約権について」「13.種類株式の発行について」の記載は当該変更を反映していない記載となっていますが、「4.募集株式の種類及び数(上限)」「5.募集株式の払込金額」及び「11.増加する資本金及び資本準備金」の記載内容は当該変更を反映した記載となっています。 -
募集株式の発行者の商号及び住所、資本金等
株式会社NPT
東京都品川区上大崎二丁目15番19号MG目黒駅前資本金: 279,950,000円(2022年10月21日現在) 発行済株式総数: 2,162株(2022年10月21日現在) 発行可能株式総数: 7,000株 設立日: 2018年11月1日 決算日: 10月31日 -
募集株式の発行者の代表者
代表取締役 原健一郎
-
発行者における株主管理に関する事項
株式会社NPTによる株主名簿及び新株予約権原簿の管理
【連絡先】
電話番号:03-6455-7150
メールアドレス:acc@neopt.jp
企業のリスク等
株式会社NPT株式に投資するにあたってのリスク・留意点等の概要
※以下は株式会社NPT株式に投資するにあたってのリスク・留意点等の概要です。詳細については必ず契約締結前交付書面をご確認ください。また、一般的なリスク・留意点については 「重要事項説明書」をご確認ください。
発行する株式は譲渡制限が付されており、当該株式を譲渡する際は発行者の承認を受ける必要があるため、当該株式の売買を行っても権利の移転が発行者によって認められない場合があります。また、換金性が乏しく、売りたいときに売れない可能性があります。
募集株式は非上場の会社が発行する株式であるため、取引の参考となる気配及び相場が存在いたしません。また、換金性も著しく劣ります。
募集株式の発行者の業務や財産の状況に変化が生じた場合、発行後の募集株式の価格が変動することによって、価値が消失する等、その価値が大きく失われるおそれがあります。
募集株式は、社債券のように償還及び利息の支払いが行われるものではなく、また、株式ではありますが配当が支払われないことがあります。
募集株式について、金融商品取引法に基づく開示又は金融商品取引所の規則に基づく情報の適時開示と同程度の開示は義務付けられていません。
有価証券の募集は、金融商品取引法第4条第1項第5号に規定する募集等(発行価額が1億円未満の有価証券の募集等)に該当するため、金融商品取引法第4条第1項に基づく有価証券届出書の提出を行っていません。
発行者の財務情報について、監査法人による監査が行われています。
発行者は前々期決算期末(2021年10月31日)及び直近試算表(2022年9月30日)において債務超過ではありません。今後、売上高が予想通りに推移しない場合、債務超過に陥るリスクがあります。
発行者の前々期決算期末(2021年10月31日)及び直近試算表(2022年9月30日)において営業損失が計上されています。今後、売上高が予想通りに推移しない場合、営業損失が継続するリスクがあります。
今後の市場動向及び市場規模など不確実性を考慮した場合、競合他社の参入等により当該会社の市場シェアの拡大が阻害され収益性が損なわれるリスクがあります。
発行者の設立日は2018年11月1日であり、税務署に提出された決算期(2021年10月31日)は第3期であり、第4期は税務申告準備中、現在は第5期となっています。 上場企業等と比較して銀行借入等による融資や各種増資について円滑に進行しない可能性があります。 発行者の資金調達計画(今回の募集株式の発行による増資を含む)が想定通りに進行せず、事業拡大に必要な資金が調達できない場合、事業計画及び業績に影響を及ぼす可能性があります。発行者は当募集において目標募集額を2,500万円、上限応募額を9,990万円として調達を実行します。 但し、現時点では上記資金調達が実行される保証はありません。なお、発行者は当募集後、2023年4月に不足分の資金調達を予定(※ただし、今回の資金調達により上限応募額に到達した場合は、2023年4月の不足分の調達は行わない予定です。)していますが、売上実績が想定どおりに進まない場合には予定している資金調達に悪影響を及ぼし、今後の資金繰りが悪化するリスクがあります。
発行者は創業以来、配当を実施していません。また、事業計画の期間に獲得を計画しているキャッシュ・フローは事業拡大のための再投資に割り当てる計画です。 そのため、将来的に投資家還元の方法として配当を実施する可能性はありますが、事業計画の期間においては配当の実施を予定していません。
発行者の事業において販売するサービスは、販売時の景気動向、市場の需給状況により予定販売単価及び想定販売数量を大幅に下回る可能性があります。
著しい売上高の下落、予想外のコストの発生、現時点で想定していない事態の発生などの事象により、資金繰りが悪化するリスクがあります。
発行者は、事業を実施するにあたり関連する許認可が必要となる可能性があります。 発行者が既に必要な許認可を得ている場合であっても、法令に定める基準に違反した等の理由により、あるいは規制の強化や変更等がなされたことにより、 その後に係る許認可が取り消され、事業に重大な支障が生じるリスクがあります。
発行者の事業は、代表取締役原健一郎氏の働きに依存している面があり、同氏に不測の事態が発生した場合、発行者の事業展開に支障が生じる可能性があります。
ファンディング・プロジェクトが成立しても、払込金額及び振込手数料が一部のお客様より払い込まれないことにより、発行者が当初目的としていた業務のための資金調達ができず、発行者の財務状況・経営成績に悪影響を及ぼす可能性があります。
発行者から当社に対しては、審査料10万円(税込:11万円)が支払われるほか、今回の株式投資型クラウドファンディングが成立した場合、募集取扱業務に対する手数料として、株式の発行価格の総額の20%(税込:22%)相当額(2度目以降の場合は総額の15%(税込:16.5%)相当額)が支払われます。また、企業情報開示のためのシステム利用や当社サポート機能の提供に対するシステム及びサポート機能利用料として、毎月5万円(年間60万円)(税込:5万5千円(年間66万円))と決算期に5万円(税込:5万5千円)を発行者から当社が申し受けます。なお、当社が定める期限までに月次、四半期及び決算に関する企業情報等が開示された場合、システム及びサポート機能利用料は免除されます。


